
分析 (1)发生的反应为:①CH4+4CuO=CO2↑+2H2O↑+4Cu,②2NH3+3CuO=N2↑+3H2O↑+3Cu.,当甲烷,氨气完全反应后,硬质玻璃管的质量减轻14.4g,可知减少的质量为氧元素的质量,利用差量法,以及生成氮气的量;
(2)根据碳元素守恒,n(CO2)=n(BaCO3)=$\frac{39.4g}{197g/mol}$=0.2mol,则原混合气中n1(CO2)=0.2mol-0.15mol=0.05mol,并据w=$\frac{n}{n总}$×100%,求物质的量分数.
解答 解:(1)n(N2)=$\frac{2.24L}{22.4L/mol}$=0.1mol,
2NH3+3CuO=N2↑+3H2O↑+3Cu~△m=48g
2 1 48
0.2 0.1 4.8
则:n(NH3)=0.2mol,△m=4.8g,
CH4+4CuO=CO2↑+2H2O↑+4Cu~△m=64g
1 1 64
0.15 0.15 1 4.4-4.8
则:n(CH4)=0.15mol,n(CO2)=0.15mol,
故答案:0.15;
(2)根据碳元素守恒,n(CO2)=n(BaCO3)=$\frac{39.4g}{197g/mol}$=0.2mol,则原混合气中n1(CO2)=0.2mol-0.15mol=0.05mol,故n(总)=n1(CO2)+n(CH4)+n(NH3)=0.05mol+0.15mol+0.2mol=0.4mol,故w(CH4)=$\frac{n}{n总}$×100%=$\frac{0.15mol}{0.4mol}×100%$=37.5%,
故答案为:37.5%.
点评 本题考查了混合物的有关计算,题目难度中等,注意掌握有关混合物反应的计算方法,并且注意元素守恒在计算中的应用.


科目:高中化学 来源: 题型:推断题
 .
. ,其分子中含(填“含”或“不含”)σ键,不含(填“含”或“不含”)π键.
,其分子中含(填“含”或“不含”)σ键,不含(填“含”或“不含”)π键.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ③②① | C. | ②③① | D. | ③①② |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除去乙酸乙酯中的少量乙酸:加入饱和Na2CO3溶液,分液 | |
| B. | 除去Fe2O3中的少量Al2O3:加入过量NaOH溶液,过滤,洗涤干燥 | |
| C. | 除去氯气中的少量氯化氢:通过盛有饱和食盐水溶液的洗气瓶 | |
| D. | 提取溶解在水中的少量碘:加入酒精,振荡、静置分层后,取出有机层再分离 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠与盐酸反应最剧烈,产生的氢气最多 | |
| B. | 铝与盐酸反应的速率仅次于钠,产生的气体也没有钠与盐酸反应产生气体多 | |
| C. | 铁与盐酸反应产生的气体比铝与盐酸反应产生的气体多 | |
| D. | 铝与盐酸反应和铁与盐酸反应产生的气体一样多 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
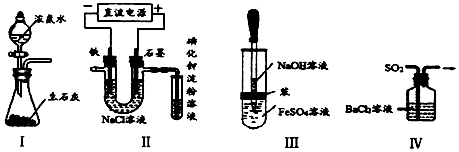
| A. | 实验Ⅰ:所示装置可制备氨气 | |
| B. | 实验Ⅱ:检验电解饱和食盐水的产物C12 | |
| C. | 实验Ⅲ:制取并观察Fe(OH)2沉淀 | |
| D. | 实验Ⅳ:吸收SO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com