
分析 气态烷烃和气态单烯烃混合气体对氢气的相对密度为12,则混合气体的平均相对分子质量为12×2=24,由于烯烃中乙烯的相对分子质量最小为28,故一定含有甲烷,反应后冷却到原来的温度(高于100℃)混合气体的压强增大,则混合气体的体积增大,而氢原子数为4的烃燃烧冷却到原来温度(高于水沸点)体积不变,则体积增大由烯烃燃烧导致,设烯烃的组成为CnH2n,其体积为x,则CH4体积为1-x,结合燃烧方程式表示出气体体积增大,再结合体积增大及平均相对分子质量列方程计算解答.
解答 解:气态烷烃和气态单烯烃混合气体对氢气的相对密度为12,则混合气体的平均相对分子质量为12×2=24,由于烯烃中乙烯的相对分子质量最小为28,故一定含有甲烷,
反应后冷却到原来的温度(高于100℃)混合气体的压强增大,则混合气体的体积增大,而氢原子数为4的烃燃烧冷却到原来温度(高于水沸点)体积不变,则体积增大由烯烃燃烧导致,
设烯烃的组成为CnH2n,其体积为x,则CH4体积为1-x,则:
CH4(气)+2O2(气)=CO2(气)+2H2O(气)
CnH2n(气)+$\frac{3n}{2}$O2(气)=nCO2(气)+nH2O(气) 体积增大△V
1 $\frac{n}{2}$-1
x x($\frac{n}{2}$-1)
由体积改变可得:x($\frac{n}{2}$-1)=5×(1.04-1)=0.2
由混合烃的相对平均分子质量可得:16(1-x)+(12n+2n)x=24
联立方程,解得:x=0.2,n=4
故混合烃中烯烃为C4H8,其占有的体积为20%,烷烃为CH4,占有体积为(1-0.2)×100%=80%,
答:混合烃中烯烃为C4H8,其占有的体积为20%,烷烃为CH4,占有体积为(1-0.2)×100%=80%.
点评 本题考查混合物计算,关键是确定含有甲烷及烯烃燃烧导致体积增大,学生容易只考虑H原子数目判断烯烃为丙烯或丁烯,忽略验证相对分子质量是否满足,题目利用方程组进行解答可以避免上述问题.


科目:高中化学 来源: 题型:选择题
| A. | 17.6 g 丙烷中所含的极性共价键为 4NA | |
| B. | 常温常压下,2.24 L 乙烯中电子总数为1.6NA | |
| C. | 溴乙烷加入NaOH溶液、加热再加入AgNO3有浅黄色沉淀生成 | |
| D. | 26克C2H2、苯、苯乙烯组成的混合物所含碳原子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.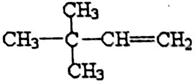 或
或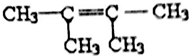 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 吸热88kJ | B. | 吸热2.44 kJ | C. | 放热44kJ | D. | 吸热44 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径大小顺序:r(Y)>r(Z)>r(W)>r(M) | |
| B. | 由三种元素X、Z、W形成的化合物中只有共价键而无离子键 | |
| C. | Z的气态氢化物比W的气态氢化物更稳定 | |
| D. | 分子式为Y4X8W2的物质超过10种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 人们基于盐沸点较高的特性制作食物,如盐炯鸡等 | |
| B. | 基于醋的酸性,人们制作出了酪掩食品.如掩黄瓜、腌蒜等 | |
| C. | 碳酸饮料需低温保存是因为温度越低溶于水中的二氧化碳就越多 | |
| D. | 鱼腥味的罪魁祸首是鱼体内的碱性物质,做鱼时加入少量醋可发生中和反应清除异味. |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将过量的Zn投入一定量的浓H2SO4中,最终生成的气体只有SO2 | |
| B. | 向装有Fe(NO3)2溶液的试管中加入稀H2SO4,在管口观察到红棕色气体 | |
| C. | 向50mL12mol•L-1的浓硝酸中加入足量铜片其充分反应,生成0.3molNO2 | |
| D. | 运输保存浓硫酸的槽罐车一旦泄露后应立即用大量水冲洗 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com