
【题目】根据要求填空:
(1)下列各组物质:
①金刚石和C60 ②H、D和T ③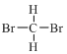 和
和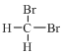 ④CH3(CH2)2CH3 和 (CH3)2CHCH3 ⑤正戊烷和异戊烷 ⑥(CH3)3CH2CH2CH3和CH3CH2CH2CH2CH3 ⑦H2O、T2O和D2O
④CH3(CH2)2CH3 和 (CH3)2CHCH3 ⑤正戊烷和异戊烷 ⑥(CH3)3CH2CH2CH3和CH3CH2CH2CH2CH3 ⑦H2O、T2O和D2O
互为同位素的是(填序号,下同)___,互为同素异形体的是______,互为同系物的是_____,属于同分异构体的是_______。
(2)书写下列物质的结构简式:
①2,6-二甲基-4-乙基辛烷:_________________
②2-甲基-1-戊烯:____________________
(3)按要求填空:
①分子式为C8H10的芳香烃,苯环上的一溴取代物只有一种,写出该芳香烃的结构简式: ______;
②C6H13Cl的同分异构体共有______种,请写出结构中仅含有四个甲基的所有同分异构体的结构简式:__________________。
③用系统命名法命名 ______________________________
______________________________
【答案】② ① ⑥ ④⑤ 
![]()
![]() 17
17 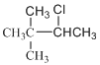
 2-甲基-4-乙基庚烷
2-甲基-4-乙基庚烷
【解析】
(1)同位素:质子数相同、中子数不同的同一元素的不同核素;同分异构体:分子式相同、结构不同的化合物;同系物:结构相似,分子组成上相差一个或若干个CH2的有机化合物;同素异形体:由相同元素组成的形态不同的单质;根据定义分析;
(2)①最长的主链含有8个C原子,甲基处于2、6号碳原子上,乙基处于4号碳原子上,据此书写;
②含有C=C双键的碳链有5个碳原子,从C=C双键一端编号,甲基处于2号碳原子上;
(3)①分子式为C8H10的芳香烃,存在四种同分异构体:乙苯、邻二甲苯、间二甲苯和对二甲苯;苯环上的一溴取代物只有一种,说明苯环上只含有1种等效H,根据苯环上含有等效氢原子数目写出满足条件的芳香烃的结构简式;
②根据同分异构体书写原则判断其种类;根据要求书写含有四个甲基的同分异构体;
③烷烃的命名顺序是:先选主链,再进行编号,然后书写其名称。
(1)①金刚石和C60均是由碳元素形成的不同单质,是同素异形体;
②H、D和T是氢元素的不同原子,互为同位素;
③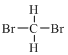 和
和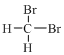 分子式相同,结构相同,为同种物质;
分子式相同,结构相同,为同种物质;
④CH3(CH2)2CH3和(CH3)2CHCH3分子式相同,碳链结构不同,互为同分异构体;
⑤正戊烷和异戊烷分子式相同,碳链结构不同,互为同分异构体;
⑥(CH3)3CH2CH2CH3和CH3CH2CH2CH2CH3结构相似,都属于烷烃,分子组成相差1个CH2原子团,互为同系物;
⑦H2O、T2O和D2O均是氢元素和氧元素形成的结构和组成相同的化合物,属于同一种物质;综上所述,互为同位素的是②,互为同素异形体的是①,互为同系物的是⑥,属于同分异构体的是④⑤;
(2)①2,6二甲基4乙基辛烷中最长的主链含有8个C原子,甲基处于2、6号碳原子上,乙基处于4号碳原子上,其结构简式为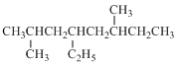 ;
;
②2甲基1戊烯分子中含有C=C双键的碳链有5个碳原子,从C=C双键一端编号,甲基处于2号碳原子上,其结构简式为![]() ;
;
(3①分子式为C8H10的芳香烃有四种: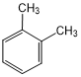 、
、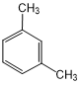 、
、![]() 、
、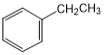 ,
,
 ,分子中,苯环上有3种不同氢原子,所以苯环上的一溴取代物有3种;
,分子中,苯环上有3种不同氢原子,所以苯环上的一溴取代物有3种;
 分子中,苯环上有2种不同氢原子,所以苯环上的一溴取代物有2种;
分子中,苯环上有2种不同氢原子,所以苯环上的一溴取代物有2种;
 分子中,苯环上有3种不同氢原子,所以苯环上的一溴取代物有3种;
分子中,苯环上有3种不同氢原子,所以苯环上的一溴取代物有3种;
![]() 分子中,苯环上有1种氢原子,所以苯环上的一溴取代物只有1种,故答案为:
分子中,苯环上有1种氢原子,所以苯环上的一溴取代物只有1种,故答案为:![]() ;
;
②C6H13Cl为烷烃的一氯代物,其碳链异构以及氯原子取代位置如下: 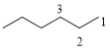 (3种)、
(3种)、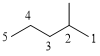 (5种)、
(5种)、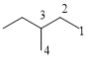 (4种)、
(4种)、![]() (3种)、
(3种)、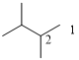 (2种),共3+5+4+3+2=17种;其中含有四个甲基的有:
(2种),共3+5+4+3+2=17种;其中含有四个甲基的有: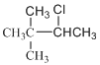 、
、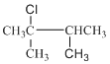 ;
;
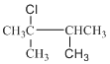
③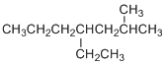 的主链以及碳原子编号为:
的主链以及碳原子编号为: ,主链为庚烷,2号C上有1个甲基,4号C上有一个乙基,故其名称为:2-甲基-4-乙基庚烷。
,主链为庚烷,2号C上有1个甲基,4号C上有一个乙基,故其名称为:2-甲基-4-乙基庚烷。


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:
【题目】可逆反应:2NO2(g)![]() 2NO(g)+ O2(g) 在体积不变的密闭容器中进行,达到平衡状态的标志是( )
2NO(g)+ O2(g) 在体积不变的密闭容器中进行,达到平衡状态的标志是( )
①单位时间内生成n mol O2的同时生成2n mol NO2
②单位时间内生成n mol O2的同时生成2n mol NO
③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2:2:1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
A. ①④ B. ②③⑤ C. ①③④ D. ①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在2L容器中X、Y、Z三种气体物质的物质的量(n)随着时间(t)变化的曲线如图所示。由图中数据

(1)该反应的化学方程式为_________________。
(2)反应开始至2min,用Z表示的平均反应速率为_____________。
(3)下列叙述能说明上述反应达到平衡状态的是_____________(填序号)。
A.X、Y、Z的物质的量之比为3∶1∶2
B.混合气体的压强不随时间的变化而变化
C.单位时间内每消耗3molX,同时生成2molZ
D.混合气体的总质量不随时间的变化而变化
E.混合气体的总物质的量不随时间的变化而变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是1molCO(g)和2molH2(g)发生反应CO(g)+2H2(g)→CH3OH(g)过程中的能量变化曲线。曲线a表示不使用催化剂时反应的能量变化,曲线b表示使用催化剂时反应的能量变化。下列相关说法正确的是( )

A.使用催化剂后该反应从放热反应变成了吸热反应
B.使用和不使用催化剂相比反应的能量变化不同
C.1molCO(g)和2molH2(g)中的化学键完全被破坏需要吸收510kJ能量
D.1molCO(g)和2molH2(g)完全反应生成1molCH3OH(g)会释放出91kJ能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学利用如图装置模拟工业生产制备了少量硝酸,请结合所学知识完成下列问题。

(1)实验时先用酒精喷灯加热催化剂,然后通入反应气体,当催化剂红热后撤离酒精喷灯,催化剂始终保持红热,温度可达到700℃以上。下列图示中,能够正确表示该反应过程能量变化的是_____(填字母)。
A.
B.
C.
(2)高温时,2NO2(g)![]() 2NO(g)+O2(g),因此氨气与氧气反应难以生成NO2。根据下列数据计算,当2molNO2分解时,反应会_____(填“吸收”或“放出”)_____kJ能量。
2NO(g)+O2(g),因此氨气与氧气反应难以生成NO2。根据下列数据计算,当2molNO2分解时,反应会_____(填“吸收”或“放出”)_____kJ能量。
NO2(g)![]() N(g)+2O(g)
N(g)+2O(g)
NO(g)![]() N(g)+O(g)
N(g)+O(g)
O2(g)![]() 2O(g)
2O(g)
(3)在2L的密闭绝热容器中,通入等物质的量的NO和O2气体,n(NO)随时间的变化如下表:
t/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.012 | 0.008 | 0.005 | 0.004 | 0.004 |
①反应开始至第2s时,NO的平均反应速率为_____。
②在第5s时,O2的转化率为_____。
③容器中混合气体压强与反应开始时的压强比值为_____。
④下列能说明反应已达平衡的是_____。
a.单位时间内,每生成一定物质的量浓度的NO,同时有相同物质的量浓度的/span>NO2生成
b.气体混合物物质的量不再改变
c.气体混合物平均相对分子质量不再改变
d.容器内温度不再发生变化
e.密闭容器内气体颜色不再改变
f.混合气的密度不再改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】10L含有丙烯,丁炔和甲烷的混合物与足量O2混合点燃后,恢复到原来状态(常温、常压),气体体积共缩小21L ,则甲烷的体积分数为
A. 20% B. 30% C. 80% D. 无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ni2O3主要用作陶瓷、搪瓷和玻璃的着色剂,也可用于镍粉的制造。以镍粉废料为原料制备Ni2O3的工艺如下:
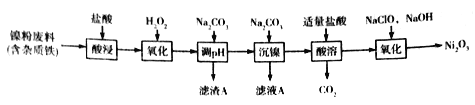
回答下列问题:
(1)Ni2O3中Ni的化合价为_________。
(2)提高“酸浸”、“酸溶”速率时,温度不宜过高,其原因是__________。
(3)加入H2O2“氧化”的离子方程式为_____________;滤渣A的主要成分是________(填化学式)。
(4)工艺中分步加入Na2CO3的作用是________;为提高原料的利用率,应控制加入NaClO与NaOH的物质的量之比为_________。
(5)工业上,用镍为阳极,电解0.1mol/L NiCl2溶液与一定量NH4Cl组成的混合溶液,可得高纯度的球形超细镍粉。当其他条件一定时,NH4Cl的浓度对阴极电流效率(电流效率是指电解时,在电极上实际沉积的物质的量与理论析出量之比)及镍的成粉率的影响如图所示:
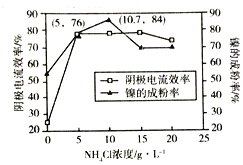
①为获得高纯度的球形超细镍粉,NH4Cl溶液的浓度最好控制为______mol/L.
②当NH4Cl溶液的浓度大于15g/L时,阴极有气体生成,导致阴极电流效率降低,请结合平衡移动原理解释其原因:_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上利用无机矿物资源生产部分材料的流程示意图如下。下列说法不正确的是( )

A. 在铝土矿制备较高纯度Al的过程中常用到NaOH溶液、CO2气体、冰晶石
B. 石灰石、纯碱、石英、玻璃都属于盐,都能与盐酸反应
C. 在制粗硅时,被氧化的物质与被还原的物质的物质的量之比为2∶1
D. 黄铜矿(CuFeS2)与O2反应产生的Cu2S、FeO均是还原产物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com