
【题目】下列图中的实验方案,不能达到相应实验目的是
A.对钢铁闸门防腐保护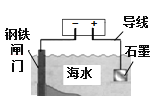
B.除去CO2气体中混有的SO2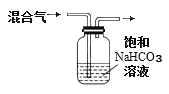
C.验证CH3CH2Br与NaOH乙醇溶液共热产物有乙烯生成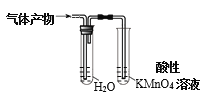
D.验证CuSO4对H2O2分解反应有催化作用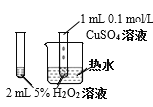
 名师点拨卷系列答案
名师点拨卷系列答案科目:高中化学 来源: 题型:
【题目】分子式为C12H14O2的F有机物广泛用于香精的调香剂。为了合成该物质,某实验室的科技人员设计了下列合成路线:
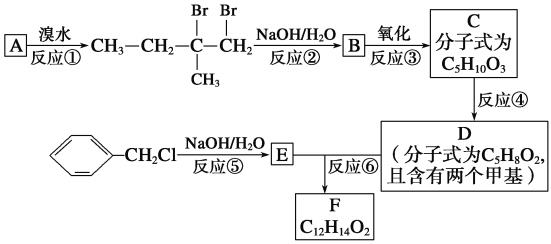
试回答下列问题:
(1)A物质在核磁共振氢谱中能呈现________种峰;峰面积比为__________。
(2)上述合成路线中属于取代反应的是__________(填编号)。
(3)写出反应⑤、⑥的化学方程式:
⑤____________________________________________________________________;
⑥____________________________________________________________________。
(4)F有多种同分异构体,请写出符合下列条件的所有物质结构简式:①属于芳香族化合物,且含有与F相同的官能团;②苯环上有两个取代基,且苯环上的一氯代物只有两种;③其中一个取代基为—CH2COOCH3:______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛、铬、铁、镍、铜等金属及其化合物在工业上有重要用途。
(1)钛铁合金是钛系储氢合金的代表,该合金具有放氢温度低、价格适中等优点。
① Ti的基态原子价电子排布式为________;
② Fe的基态原子共有______种不同能级的电子;
(2)制备CrO2Cl2的反应为K2Cr2O7+3CCl4=2KCl+2CrO2Cl2+3COCl2↑。
① 上述化学方程式中非金属元素电负性由大到小的顺序是_______;
② COCl2分子中σ键和π键的个数比为______,中心原子的杂化方式为_______;
(3)NiO、FeO的晶体结构均与氯化钠的晶体结构相同,其中Ni2+和Fe2+的离子半径分别为6.9×10-2 nm和7.8×10-2 nm。则熔点:NiO_______(填“>”、“<”或“=”)FeO。
(4)铁的某种单质的晶胞为面心立方结构,原子的配位数为_______,若铁原子半径为a nm,则该单质的密度为_______g/cm3;
(5)Fe2O3与KNO3和KOH固体高温加热可制备一种“绿色”环保高效净水剂K2FeO4(高铁酸钾),其中KNO3被还原为KNO2,写出该反应方程式_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A是最常用的食用油抗氧化剂,分子式为C10H12O5,可发生如下转化
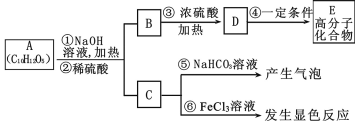
已知B的相对分子质量为60,分子中只含一个甲基。C的结构可表示为:
 (其中:—X、—Y均为官能团)
(其中:—X、—Y均为官能团)
请回答下列问题:
(1)官能团-X的名称为____,反应③的类型为____;
(2)根据系统命名法,B的名称为____,高聚物E的链节为____;
(3)A的结构简式为____;
(4)反应⑤的化学方程式为____;
(5)C有多种同分异构体,其中符合下列要求的同分异构体共____种;
i.含有苯环 ii.能发生银镜反应 iii.不能发生水解反应
(6)从分子结构上看,A具有抗氧化作用的主要原因是____(填序号)。
a 含有苯环 b 含有羰基 c 含有酚羟基
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 氢原子的电子云图中小黑点的疏密表示电子在核外单位体积内出现机会的多少
B. 最外层电子数为ns2的元素都在元素周期表第2列
C. 处于最低能量的原子叫做基态原子,1s22s22![]() →1s22s22
→1s22s22![]() 过程中形成的是发射光谱
过程中形成的是发射光谱
D. 已知某元素+3价离子的电子排布式为1s22s22p63s23p63d5,该元素位于周期表中的第四周期第VIII族位置,属于ds区
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】制备水合肼(N2H4·H2O)的反应原理是CO(NH2)2+ 2NaOH + NaClO=Na2CO3+N2H4·H2O+NaCl。已知CO(NH2)2沸点:133 ℃;水合肼是重要化工原料,沸点:118 ℃,易被氧化。请按要求回答下列制备水合肼实验的有关问题。
(1)制备 NaClO 溶液(实验装置如图所示)
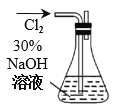
锥形瓶中发生反应离子方程式是__________________________。
(2)制取水合肼(实验装置如右图所示,夹持装置已略)
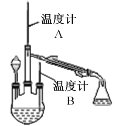
控制反应温度,再将分液漏斗中溶液缓慢滴入三颈烧瓶中,充分反应后,加热蒸馏三颈烧瓶内的溶液,收集产品。
①分液漏斗中盛装的药品是NaOH溶液和_______________。
这样盛放的理由是防止___________________________________。
②本实验收集产品馏分时的关键条件是控制_______________________________。
(3)测定馏分中肼的含量。
①已知水合肼在一定条件下与I2反应生成N2,完成该反应原理的化学方程式:
____N2H4·H2O +____ I2 +6NaHCO3+H2SO4 = ____ N2↑+____ NaI +6CO2↑+Na2SO4 +7H2O
__________________________
②测定实验的步骤如下:
a.称取馏分 5.000 g,加水配制成1000 mL待测液溶液。
b.移取10.00 mL于锥形瓶中,加入10 mL水、稀硫酸、适量 NaHCO3固体(保证滴定过程中溶液的 pH 保持在 6.5左右)、2滴淀粉溶液,摇匀。
c.用0.2000 mol/L I2溶液滴定,至溶液呈现___________________________,记录消耗I2标准液的体积。
d._______________________________;然后处理数据。
③经数据处理,滴定消耗I2的标准溶液为 8.20 mL,馏分中水合肼(N2H4·H2O)的质量分数为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通常情况下,氯化钠、氯化铯、二氧化碳和二氧化硅的晶体结构分别如下图所示,下列关于这些晶体结构和性质的叙述不正确的是 ( )

A. 同一主族的元素与另一相同元素所形成的化学式相似的物质不一定具有相同的晶体结构
B. 氯化钠、氯化铯和二氧化碳的晶体都有立方的晶胞结构,它们具有相似的物理性质
C. 二氧化碳晶体是分子晶体,其中不仅存在分子间作用力,而且也存在共价键
D. 在二氧化硅晶体中,平均每个Si原子形成4个Si-O共价单键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜镁合金1.52g完全溶解于50mL密度为1.40g·mL-1、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体1120mL(标准状况),向反应后的溶液中加入1.0mol·L-1NaOH溶液,当金属离子全部沉淀时,得到2.54g沉淀。下列说法不正确的是( )
A.该合金中铜与镁的物质的量之比是2:1
B.得到2.54g沉淀时,加入NaOH溶液的体积是600mL
C.该浓硝酸中HNO3的物质的量浓度是14.0mol·L-1
D.NO2和N2O4的混合气体中,NO2的体积分数是80%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com