
 $?_{暗处}^{光照}$
$?_{暗处}^{光照}$ △H=+88.6kJ•mol-1
△H=+88.6kJ•mol-1分析 (1)依据转化过程中M、N的能量高低分析判断,能量越高越活泼;可逆反应正逆反应的焓变大小相同符号相反;
(2)根据液态水转化成分气态水时要吸收热量分析;
(3)依据热化学方程式的书写方法,结合燃烧热的概念是1mol可燃物完全燃烧生成稳定氧化物时放出的热量写出,注意标注物质的聚集状态和燃烧热;
(4)a、CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.2kJ•mol-1;
b、2CO(g)+4H2 (g)?CH3CH2OH(g)+H2O(g)△H=-256.1kJ•mol-1;
依据盖斯定律b-a×2计算得到.
解答 解:(1)转化过程是吸热反应,M的能量低于N,说明M稳定;在暗处反应即逆向进行,所以△H=-88.6kJ•mol-1,故答案为:M;-88.6kJ•mol-1;
(2)因为液态水转化成分气态水时要吸收热量,所以生成液态水放出的热量多,又放热焓变为负值,所以a<b,故答案为:<;
(3)CH4 是一种清洁、高效、具有优良的环保性能的燃料,其燃烧热为890.3KJ•mol-1,热化学方程式为:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3KJ/mol,
故答案为:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3KJ/mol;
(4)a、CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.2kJ•mol-1;
b、2CO(g)+4H2 (g)?CH3CH2OH(g)+H2O(g)△H=-256.1kJ•mol-1;
依据盖斯定律b-a×2得到:2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(l)△H=-173.7kJ•mol-1 ;
故答案为:-173.7kJ•mol-1 .
点评 本题考查了热化学方程式的书写和分析判断,燃烧热概念的应用,掌握基础是关键,题目难度中等.


科目:高中化学 来源: 题型:选择题

| A. | BaCl2、H2SO4、MgCl2 | B. | CaCl2、HNO3、AgNO3 | ||
| C. | CaCl2、HNO3、NaCl | D. | BaCl2、HCl、Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
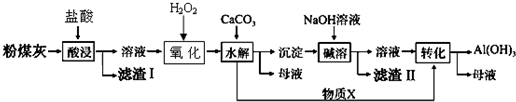
| 沉淀物 | Cu(OH)2 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀pH | 5.4 | 4.0 | 1.1 | 5.8 |
| 沉淀完全pH | 6.7 | 5.2 | 3.2 | 8.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 工作时,电解质溶液中K+向负极移动 | |
| B. | 电路若有0.4mol电子通过,则消耗O2的量为0.2mol | |
| C. | 一段时间后溶液中OH-浓度将升高 | |
| D. | 正极反应式为:O2+4e-+2H2O═4OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 超导材料是材料研究的热点之一.我国化学家赵忠贤1987年发现了温度为110K的超导材料-铊钡钙铜氧系合金.请回答下列问题:
超导材料是材料研究的热点之一.我国化学家赵忠贤1987年发现了温度为110K的超导材料-铊钡钙铜氧系合金.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯、乙烯分别使溴水褪色 | |
| B. | 溴乙烷分别在NaOH的水溶液、NaOH的醇溶液中反应 | |
| C. | 乙烯、甲苯使酸性KMnO4溶液褪色 | |
| D. | 苯、甲苯在一定条件下与混酸反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com