
【题目】某化学小组设计了如图甲所示的数字化实验装置,研究常温下,向1L0.1mol/LH2A溶液中逐滴加入等浓度NaOH溶液时的pH变化情况,并绘制出溶液中含A元素的粒子的物质的量分数与溶液pH的关系如图乙所示,则下列说法中正确的是( )
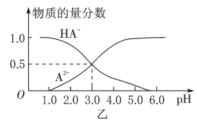
A.pH=4.0时,图中n(HA-)约为0.0091mol
B.0.1mol/LNaHA溶液中存在c(A2-)+c(HA-)+c(H2A)=0.1mol/L
C.该实验应将左边的酸式滴定管换成右边碱式滴定管并加酚酞作指示剂
D.常温下,等物质的量浓度的NaHA与Na2A溶液等体积混合后溶液pH=3.0
【答案】A
【解析】
A.pH=3时A2、HA的物质的量分数相等,所以二者的浓度相等,则Ka2=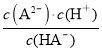 =c(H+)=0.001mol/L,由同一溶液中
=c(H+)=0.001mol/L,由同一溶液中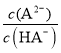 =
=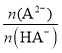 ,pH=4时该酸的第二步电离常数不变,且原溶液中n(HA)+n(A2)=0.1mol,据此计算n(HA);
,pH=4时该酸的第二步电离常数不变,且原溶液中n(HA)+n(A2)=0.1mol,据此计算n(HA);
B.该二元酸第一步完全电离,第二步部分电离,所以NaHA溶液中不存在H2A;
C.根据图知,滴定终点时溶液呈酸性;
D.pH=3时,溶液中不存在H2A,说明该酸第一步完全电离,第二步部分电离,则NaHA只电离不水解,Na2A能水解,且c(A2)=c(HA)。
A.pH=3时A2、HA的物质的量分数相等,所以二者的浓度相等,则Ka2=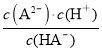 =c(H+)=0.001mol/L,由同一溶液中
=c(H+)=0.001mol/L,由同一溶液中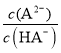 =
=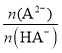 ,pH=4时该酸的第二步电离常数不变,且原溶液中n(HA)+n(A2)=0.1mol,Ka2=
,pH=4时该酸的第二步电离常数不变,且原溶液中n(HA)+n(A2)=0.1mol,Ka2=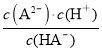 =
=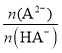 ×c(H+)=
×c(H+)=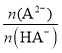 ×0.0001mol/L=0.001mol/L,n(HA)约为0.0091mol,故A正确;
×0.0001mol/L=0.001mol/L,n(HA)约为0.0091mol,故A正确;
B.该二元酸第一步完全电离,第二步部分电离,所以NaHA只能电离不能水解,则溶液中不存在H2A,根据物料守恒得c(A2)+c(HA)=0.1mol/L,故B错误;
C.根据图知,滴定终点时溶液呈酸性,应该选取甲基橙作指示剂,故C错误;
D.pH=3时,溶液中不存在H2A,说明该酸第一步完全电离,第二步部分电离,则NaHA只电离不水解,Na2A能水解,且c(A2)=c(HA);等物质的量浓度的NaHA与Na2A溶液等体积混合,因为电离、水解程度不同导致c(A2)、c(HA)不一定相等,则混合溶液的pH不一定等于3,故D错误;
故答案选A。


 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案科目:高中化学 来源: 题型:
【题目】为达到下列实验目的,对应的实验方法以及相关解释均正确的是
选项 | 实验目的 | 实验方法 | 相关解释 |
A | 测量氯水的pH |
| pH试纸遇酸变红 |
B | 探究正戊烷C5H12催化裂解 |
| C5H12裂解为分子较小的烷烃和烯烃 |
C | 实验温度对平衡移动的影响 |
| 2NO2 |
D | 用AlCl3溶液制备AlCl3晶体 |
| AlCl3沸点高于溶剂水 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应A2(g)+B(g)=2AB(g)的能量交化如图所示。下列有关叙述不正确的是

A.AB(g)的键能为b kJ·mol-1
B.反应热△H=+(a-b)kJ·mol-1
C.该反应中反应物的总能量低于生成物的总能量
D.断裂1 mol A-A键和1 mol B-B键,吸收a kJ能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(15分)Ⅰ.目前我国锅炉烟气脱硝技术有新发现,科学家对O3氧化烟气脱硝同时制硝酸进行了实验研究,其生产硝酸的机理如下:
![]()
回答下列问题:
(1)NO3分子内存在两个过氧键,且氧均满足8电子稳定结构,请写出NO3中N的化合价______;NO3极不稳定,常温下即可爆炸分解,试从电子成键角度解释NO3不稳定的原因:__________________。
(2)N2O5与O3作用也能生成NO3与氧气,根据反应前后同种元素,价态相同,不参与氧化还原反应的原则,请分析反应N2O5+O3![]() 2NO3+O2中,N2O5的作用是__________________(填“氧化剂”“还原剂”或“既是氧化剂,又是还原剂”)。
2NO3+O2中,N2O5的作用是__________________(填“氧化剂”“还原剂”或“既是氧化剂,又是还原剂”)。
(3)请写出在有水存在时,O3与NO以物质的量之比为3∶2完全反应的总化学方程式___________。
Ⅱ.下图为某学习兴趣小组对Cu与稀硝酸反应的改进实验装置图:

(4)按如图组装好仪器,检查气密性后,装药品,实验时,先关闭a,打开b,将装置B下移,使之与稀硝酸接触产生气体,当________________(填实验现象),立刻将之上提,并关闭b,这样操作的目的为________________________________。
(5)将铜丝下移,使之与稀硝酸接触,A中现象是________________,稍后将铜丝上拉,使之与稀硝酸分离;打开a,挤压E,使少量空气进入A中,A中现象是______________。
(6)打开b,交替挤压E和F,至装置内氮氧化物气体被氢氧化钠溶液充分吸收,写出NO2气体与氢氧化钠溶液充分反应的离子方程式:______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某热再生电池工作原理如图所示。放电后,可利用废热进行充电。已知电池总反应:Cu2++4NH3![]() [Cu(NH3)4]2+ ΔH<0。下列说法正确的是( )
[Cu(NH3)4]2+ ΔH<0。下列说法正确的是( )
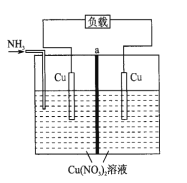
A.充电时,能量转化形式主要为电能到化学能
B.放电时,负极反应为NH3-8e-+9OH-=NO3-+6H2O
C.a为阳离子交换膜
D.放电时,左池Cu电极减少6.4g时,右池溶液质量减少18.8g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(![]() ),发生反应:
),发生反应:![]()
![]()
![]() ,体系中c(Pb2+)和c(Sn2)变化关系如右图所示。下列判断正确的是
,体系中c(Pb2+)和c(Sn2)变化关系如右图所示。下列判断正确的是
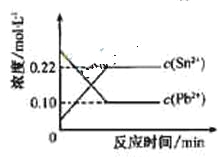
A.往平衡体系中加入少量金属铅后,c(Pb2+)增大
B.往平衡体系中加入少量![]() 固体后,c(Sn2-)变小
固体后,c(Sn2-)变小
C.升高温度,平衡体系中c(Pb2+)增大,说明该反应![]()
D.25℃时,该反应的平衡常数K=2.2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从某含Br—废水中提取Br2的过程包括:过滤、氧化、萃取(需选择合适萃取剂)及蒸馏等步骤。已知:
物质 | Br2 | CCl4 | 正十二烷 |
密度/g·cm-3 | 3.119 | 1.595 | 0.753 |
沸点/℃ | 58.76 | 76.8 | 215~217 |
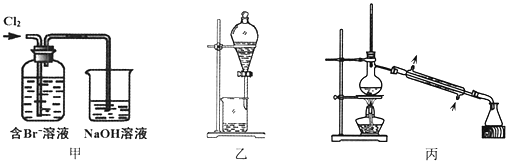
下列说法不正确的是
A. 甲装置中Br—发生的反应为:2Br-+ Cl2 = Br2 + 2Cl-
B. 甲装置中NaOH溶液每吸收0.1mol Cl2,转移0.1mol e—
C. 用乙装置进行萃取,溶解Br2的有机层在下层
D. 用丙装置进行蒸馏,先收集到的是Br2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1000![]() NaOH溶液滴定20.00mL某未知浓度的CH3COOH溶液,滴定曲线如右图所示。已知在点③处恰好中和。下列说法不正确的是( )
NaOH溶液滴定20.00mL某未知浓度的CH3COOH溶液,滴定曲线如右图所示。已知在点③处恰好中和。下列说法不正确的是( )

A. 点①②③三处溶液中水的电离程度依次增大
B. 该温度时CH3COOH的电离平衡常数约为![]()
C. 点①③处溶液中均有c(H+)=c(CH3COOH)+c(OH-)
D. 滴定过程中可能出现:c(CH3COOH)>c(CH3COO-)>c(H+)>c(Na+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
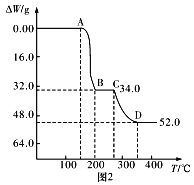
【题目】钒及其化合物在特种钢材的生产、高效催化剂的制备及航天工业中用途广泛。工业上以富钒炉渣(主要成分为V2O5,含少量Fe2O3和FeO等杂质)为原料提取五氧化二钒的工艺流程如图所示:
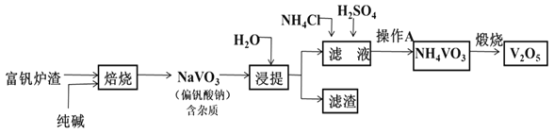
(1)五氧化二钒中钒的化合价为__。
(2)焙烧炉中发生的主要反应化学方程式为__;也可用氯化钠和氧气代替纯碱进行焙烧反应,写出对应的化学反应方程式__,该方法的缺点是:__。
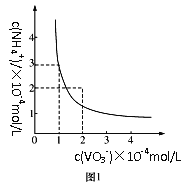
(3)已知NH4VO3难溶于水,在水中的Ksp曲线如图1所示,则在实验中进行操作A所需要的玻璃仪器有__;向10mL含NaVO30.2mol/L的滤液中加入等体积的NH4Cl溶液(忽略混合过程中的体积变化),欲使VO3-沉淀完全,则NH4Cl溶液的最小浓度为__。(当溶液中某离子浓度小于1×10-5mol/L时,认为该离子沉淀完全)
(4)为研究煅烧过程中发生的化学变化,某研究小组取234gNH4VO3进行探究,焙烧过程中减少的质量随温度变化的曲线如图2所示,则C点所得物质化学式为__,写出CD段发生反应的化学方程式:__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com