
| A. | 原子中核内质子数和核外电子数一定相等 | |
| B. | 溶液稀释前后溶质的质量一定相等 | |
| C. | 常温常压下,酸碱中和反应生成1mol液态水时放出的热量一定相等 | |
| D. | 物质发生化学变化前后,元素的种类一定相等 |
 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 (其中:-X、-Y均为官能团
(其中:-X、-Y均为官能团 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
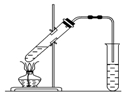 实验室用如图所示的装置制取乙酸乙酯.
实验室用如图所示的装置制取乙酸乙酯.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C是还原剂 | |
| B. | TiO2是氧化剂 | |
| C. | 生成1 mol TiCl4时,转移电子4 mol | |
| D. | 尾气必须净化处理 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | HA是弱酸 | B. | 该混合液pH>7 | ||
| C. | 该混合溶液中:c(A-)+c(Y)=c(Na+) | D. | 图中X表示HA,Y表示OH-,Z表示H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| A | ||
| E |
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com