
 Ņ»¶ØĪĀ¶ČĻĀ£¬ŌŚ2LµÄĆܱÕČŻĘ÷ÖŠ£¬X”¢Y”¢ZČżÖÖĘųĢåµÄĪļÖŹµÄĮæĖꏱ¼ä±ä»ÆµÄĒśĻßČēĶ¼ĖłŹ¾£®»Ų“šĻĀĮŠĪŹĢā£ŗ
Ņ»¶ØĪĀ¶ČĻĀ£¬ŌŚ2LµÄĆܱÕČŻĘ÷ÖŠ£¬X”¢Y”¢ZČżÖÖĘųĢåµÄĪļÖŹµÄĮæĖꏱ¼ä±ä»ÆµÄĒśĻßČēĶ¼ĖłŹ¾£®»Ų“šĻĀĮŠĪŹĢā£ŗ 2Z
2Z 2Z
2Z| ”÷c |
| ”÷t |
| ”÷c |
| ”÷t |
| ||
| 10s |
| 1.20mol-0.41mol |
| 2L |
| 1.0mol-0.21mol |
| 1.0mol |
 2Z£¬¹Ź“š°øĪŖ£ŗX+Y
2Z£¬¹Ź“š°øĪŖ£ŗX+Y 2Z£®
2Z£®

 Õć½Ö®ŠĒæĪŹ±ÓÅ»Æ×÷ŅµĻµĮŠ“š°ø
Õć½Ö®ŠĒæĪŹ±ÓÅ»Æ×÷ŅµĻµĮŠ“š°ø ¼¤»īĖ¼Ī¬ÓżÓæĪĢĆĻµĮŠ“š°ø
¼¤»īĖ¼Ī¬ÓżÓæĪĢĆĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
 Ņ»¶ØĪĀ¶ČĻĀ£¬ŌŚ2LµÄĆܱÕČŻĘ÷ÖŠ£¬X”¢Y”¢ZČżÖÖĘųĢåµÄĪļÖŹµÄĮæĖꏱ¼ä±ä»ÆµÄĒśĻßČēĶ¼ĖłŹ¾£ŗ
Ņ»¶ØĪĀ¶ČĻĀ£¬ŌŚ2LµÄĆܱÕČŻĘ÷ÖŠ£¬X”¢Y”¢ZČżÖÖĘųĢåµÄĪļÖŹµÄĮæĖꏱ¼ä±ä»ÆµÄĒśĻßČēĶ¼ĖłŹ¾£ŗ 2Z£Øg£©
2Z£Øg£© 2Z£Øg£©
2Z£Øg£©²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ

²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
| Ź±¼ä/min | 0 | 1 | 2 | 3 | 4 | 5 |
| n£ØO2£©/mol | 0.20 | 0.16 | 0.13 | 0.11 | 0.10 | 0.10 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
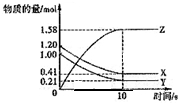 Ņ»¶ØĪĀ¶ČĻĀ£¬ŌŚ2LµÄĆܱÕČŻĘ÷ÖŠ£¬X”¢Y”¢ZČżÖÖĘųĢåµÄĪļÖŹµÄĮæĖꏱ¼ä±ä»ÆµÄĒśĻßČēĻĀĶ¼ĖłŹ¾£¬ĻĀĮŠĆčŹöÕżČ·µÄŹĒ£Ø””””£©
Ņ»¶ØĪĀ¶ČĻĀ£¬ŌŚ2LµÄĆܱÕČŻĘ÷ÖŠ£¬X”¢Y”¢ZČżÖÖĘųĢåµÄĪļÖŹµÄĮæĖꏱ¼ä±ä»ÆµÄĒśĻßČēĻĀĶ¼ĖłŹ¾£¬ĻĀĮŠĆčŹöÕżČ·µÄŹĒ£Ø””””£©| A”¢·“Ó¦æŖŹ¼µ½10s£¬ÓĆZ±ķŹ¾µÄ·“Ó¦ĖŁĀŹĪŖ0£®158moL/£ØL?s£© | B”¢l0sŗó£¬øĆ·“Ó¦Ķ£Ö¹½ųŠŠ | C”¢·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ£ŗX£Øg£©+Y£Øg£©?2Z£Øg£© | D”¢·“Ó¦æŖŹ¼µ½l0sŹ±£¬Ę½¾ł·“Ó¦ĖŁĀŹ¦Ķ£ØX£©=¦Ķ£ØY£©=0£®0395mol/£ØL?s£© |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com