
下列叙述正确的是( )
A.浓度均为0.1 mol·L-1的CH3COOH与CH3COONa溶液等体积混合后溶液显酸性,
则:c(CH3COO-)<c(CH3COOH)
B.浓度均为0.1 mol·L-1的氨水与盐酸等体积混合后的溶液中:c(H+)=c(OH-) + c(NH3·H2O)
C.浓度均为0.1 mol·L-1的小苏打溶液和氢氧化钠溶液等体积混合:
c(Na+)+ c(H+)= c(CO32-)+ c(OH-) + c(HCO3-)
D.用pH=3的HCl溶液滴定10 mL pH=11的氨水,达到滴定终点用去盐酸的体积小于10 mL
科目:高中化学 来源: 题型:
若需通过导电实验证明NaCl是离子化合物,可以选择的实验对象是( )
|
| A. | NaCl固体 | B. | NaCl水溶液 | C. | NaCl熔融液 | D. | 以上都不可以 |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知酸性: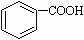 >H2CO3>
>H2CO3>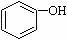 ,将
,将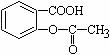 转变为
转变为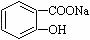 的方法是 ( )
的方法是 ( )
A.与足量的NaOH溶液共热,再通入SO2 B.与稀H2SO4共热后,加入足量的NaOH溶液
C.加热溶液,通入足量的CO2 D. 与稀H2SO4共热后,加入足量的NaHCO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
已知充分燃烧7.8g 乙炔气体时生成二氧化碳气体和液态水,并放出热量389.9kJ,则乙炔燃烧的热化学方程式正确的是( )
A.2C2H2(g) + 5O2(g) = 4CO2(g) + 2H2O(l) △H=—389.9 kJ/mol
B.C2H2(g) + 5/2O2(g) = 2CO2(g) + H2O(l) △H=—1299.6 kJ/mol
C.2C2H2(g) + 5O2(g) = 4CO2(g) + 2H2O(g) △H=-2599.2 kJ/mol
D.2C2H2(g) + 5O2(g) = 4CO2(g) + 2H2O(l) △H=—1299.6 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
已知反应①:CO(g)+CuO(s) CO2(g)+Cu(s)和反应②:H2(g)+CuO(s)
CO2(g)+Cu(s)和反应②:H2(g)+CuO(s) Cu(s)+H2O(g)在相同的某温度下的平衡常数分别为K1和K2,该温度下反应③:CO(g)+H2O(g)
Cu(s)+H2O(g)在相同的某温度下的平衡常数分别为K1和K2,该温度下反应③:CO(g)+H2O(g) CO2(g)+H2(g)的平衡常数为K。则下列说法正确的是 ( )
CO2(g)+H2(g)的平衡常数为K。则下列说法正确的是 ( )
A.反应①的平衡常数K1=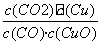
B.反应③的平衡常数K=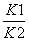
C.对于反应③,恒容时,温度升高,H2浓度减小,则该反应的焓变为正值
D.对于反应③,恒温恒容下,增大压强,H2浓度一定减小
查看答案和解析>>
科目:高中化学 来源: 题型:
I:常温下,将某一元酸HA和NaOH溶液等体积混合,分别进行编号为①、②、③的实验,实验数据记录如下表
| 序号 | HA物质的量浓度(mol·L-1) | NaOH物质的量浓度(mol·L-1) | 混合溶液的pH |
| ① | 0.1 | 0.1 | pH=9 |
| ② | c | 0.2 | pH=7 |
| ③ | 0.2 | 0.1 | pH<7 |
请回答:(1)根据①组实验情况,分析混合溶液的pH=9的原因是_________________。
(用反应的离子方程式表示),在该溶液中下列关系式不正确的是(填序号字母)________。
A.c(Na+)+c(H+)=c(OH-)+c(A-) B.c(Na+)=c(HA)+c(A-)
C.c(HA)+c(H+)=c(OH-) D.c(Na+)+c(H+)=c(OH-)+c(A-)+c(HA)
(2)②组情况表明,c 0.2mol·L-1(选填“>”、“<”或“=”)。混合溶液中离子浓度
c(A-)_____c(Na+)(选填“>”、“<”或“=”)从③组实验结果分析,说明HA的电离程度________NaA的水解程度(选填“>”、“<”或“=”)。
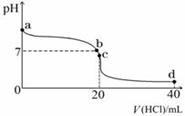 Ⅱ:室温下,若将0.1 mol·L-1盐酸滴入20 mL 0.1 mol·L-1氨水中,溶液pH随加入盐酸体积的变化曲线如下图所示。 (1)NH3·H2O的电离方程式是 。
Ⅱ:室温下,若将0.1 mol·L-1盐酸滴入20 mL 0.1 mol·L-1氨水中,溶液pH随加入盐酸体积的变化曲线如下图所示。 (1)NH3·H2O的电离方程式是 。
(2)b点所示溶液中的溶质是 。
(3)c点所示溶液中,离子浓度从大到小的关系为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数的值,则下列说法不正确的是( )
A. 1mol氯气参加氧化还原反应时电子转移2NA
B. 3.2gSO2与2.3gNO2所含有的氧原子数相等
C. 1molNa2O2与足量水反应后转移的电子数为NA
D. 1L0.1mol/LMgCl2溶液中Cl—离子数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
下表标出的是元素周期表的一部分元素,回答下列问题:
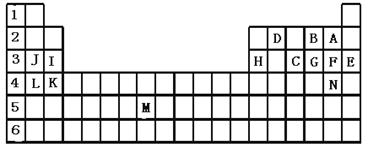 |
(1)表中用字母标出的15种元素中,化学性质最不活泼的是 (用元素符号表示,下同),金属性最强的是 ,非金属性最强的是 ,常温下单质为液态的非金属元素是 ,属于过渡元素的是 (该空用字母表示)。
(2)B,F,C气态氢化物的化学式分别为 、 、 ,其中以 最不稳定。
(3)第三周期中原子半径最小的是 (稀有气体元素除外)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下表为长式周期表的一部分,其中的序号代表对应的元素。
| ① |
| ||||||||||||||||
|
| ② |
| ③ | ④ | ⑤ | ⑥ |
| ||||||||||
|
| ⑦ |
| ⑧ |
|
|
|
| ||||||||||
|
|
|
|
|
| ⑨ |
|
|
|
| ⑩ |
|
|
|
|
|
|
|
(1)写出上表中元素⑤的轨道表示式_______,元素⑨原子的核外电子排布式__________。
(2)元素第一电离能的大小比较:④_____⑤(填写“>”“=”或“<”,下同);元素电负性的大小比较:④_____⑤(填写“>”“=”或“<”);请写出与元素④的单质互为等电子体的一种微粒的化学式_________。
(3)在测定元素①与⑥形成化合物的相对分子质量时,实验测得的值一般高于理论值的主要原因是__________。
(4)上述③与④元素组成的(CN)2化合物中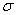 键与
键与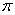 键之比________。
键之比________。
(5)⑦的氧化物是优良的耐高温材料,它的熔点比 CaO高,其原因是_____________。
(6)元素⑩的某种氧化物的晶体结构如图所示,其中实心球表示元素⑩原子,则该氧化物的化学式________。
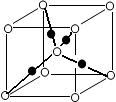
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com