
| A. | CO2 | B. | C2H2 | C. | H2O2 | D. | COCl2 |
分析 在共价键中,单键为δ键,而双键、三键中含有σ键和π键,以此解答.
解答 解:A.二氧化碳分子为共价化合物,碳原子分别与两个氧原子形成2个C=O,结构式为:O=C=O,含有双键,则一定含有π键,故A不选;
B.C2H2的结构式为H-C≡C-H,含有三键键,则一定含有π键,故B不选;
C.双氧水属共价化合物,原子之间通过共用电子对成键,分子中存在两个氧氢键和一个O-O键,结构式为H-O-O-H,只有H-O、O-O单键,为σ键,故C选;
D.COCl2的结构式为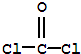 ,含有双键,则一定含有π键,故D不选;
,含有双键,则一定含有π键,故D不选;
故选C.
点评 本题考查共价键的分类,注意把握π键与σ键的区别,题目难度不大,学习中注意相关基础知识的积累.


 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 编号 | ① | ② | ③ | ④ |
| 装置 | 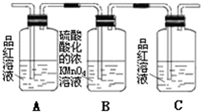 | 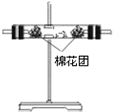 | 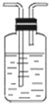 | 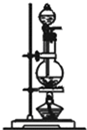 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
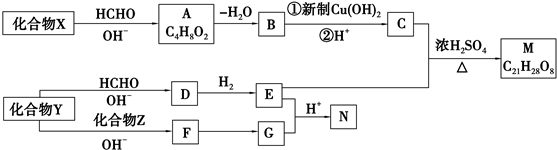
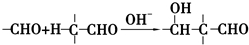
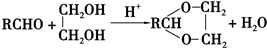
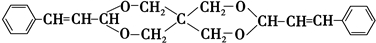
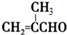 +2Cu(OH)2+NaOH$\stackrel{△}{→}$
+2Cu(OH)2+NaOH$\stackrel{△}{→}$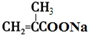 +Cu2O↓+3H2O.
+Cu2O↓+3H2O.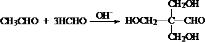 .
.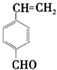 和
和 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子最外层电子数等于或大于4的元素一定是非金属元素 | |
| B. | 原子最外层只有2个电子的元素一定是金属元素 | |
| C. | 最外层电子数比次外层电子数多的元素一定位于第二周期 | |
| D. | 某元素的离子最外层电子数与次外层电子数相同,该元素一定位于第三周期 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 次氯酸钙有强氧化性,用于饮用水消毒 | |
| B. | 木炭具有还原性,用于制冰箱除味剂 | |
| C. | 氧化铝具有两性,用于工业冶炼铝单质 | |
| D. | 氯化铁溶液呈酸性,用于蚀刻铜电路板 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子化合物可能含共价键 | B. | 共价化合物可能含离子键 | ||
| C. | 离子化合物中只含离子键 | D. | 共价化合物中可能含共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | H-H | C-O | C≡C | H-O | C-H |
| E/(KJ.mol-1) | 436 | 343 | x | 465 | 413 |
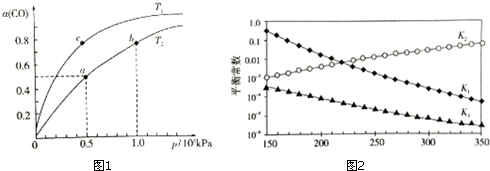
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl的电子式为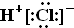 | B. | Cl-的结构示意图 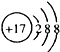 | ||
| C. | CO2的电子式 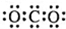 | D. | 质量数为37的氯原子 ${\;}_{37}^{17}$Cl |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com