
����Ŀ����ҵ�ϻ�������ij�Ͻ���ϣ���Ҫ��Fe��Cu��Co��Li�ȣ���֪Co��Fe��Ϊ�еȻ��ý������Ĺ���������ͼ�� 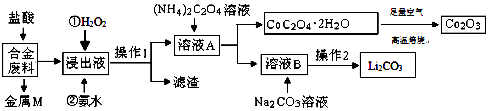 �ش��������⣺
�ش��������⣺
��1����NH4��2C2O4��C�Ļ��ϼ�Ϊ ��
��2���Ͻ���ϼ��������ȡ��������ܻ�Ϊ���ᣬԭ���� �� ����M ����Ҫ�ɷ���һ�ֽ������ʣ��ý���Ϊ ��
��3��������Һ�����Ⱥ����������Լ��漰��ˮ��H2O2��Һ��Ӧ�ȼ��� �� ���백ˮ������Ӧ�����ӷ���ʽΪ ��
��4����ҺA�еĽ����������� �� ���루NH4��2C2O4��Һ��Ŀ���� ��
��5��������l���������� �� �����ܸ��±�������Co2O3 �� ʵ�����и��±���ʹ�õ�������������ĸ���� a�������� b�������� c���ձ� d������
��6����֪Li2CO3����ˮ���䱥����Һ��Ũ�����¶ȹ�ϵ�����������2���У�����Ũ��������ȹ��ˣ���Ŀ���� �� 90��ʱKsp��Li2CO3����ֵΪ ��
�¶�/�� | 10 | 30 | 60 | 90 |
Ũ��/mol/L | 0.21 | 0.17 | 0.14 | 0.10 |
���𰸡�
��1��+3
��2�������ܽ����ʱ�������ж����壬��CuҲ�ܽ��������У�Cu
��3��H2O2��Һ��Fe3++3NH3?H2O=Fe��OH��3��+3NH4+
��4��Co2+��Li+��ʹCo2+ת��Ϊ�����ܳ���
��5�����ˣ�d
��6������Li2CO3���ܽ���ʧ��4.0��10��3
���������⣺��1�����ݻ��ϼ۴�����Ϊ0���� NH4��2C2O4��C�Ļ��ϼ�Ϊ+3�����Դ��ǣ�+3����2����Ϊ�����ܽ����ʱ�������ж����壬��CuҲ�ܽ��������У���������ܻ�Ϊ���ᣬ���������жϽ���MΪCu�����Դ��ǣ������ܽ����ʱ�������ж����壬��CuҲ�ܽ��������У�Cu����3������H2O2��������������������Ϊ�����ӣ����백ˮ�������ǵ�����ҺPHʹFe3+ת��ΪFe��OH��3���������ӷ���ʽΪ��Fe3++3NH3H2O=Fe��OH��3��+3NH4+ �� ����Ӧ�ȼ���H2O2��Һ�����Դ��ǣ�H2O2��Һ��Fe3++3NH3H2O=Fe��OH��3��+3NH4+����4���������Ϸ�������ҺA�еĽ�����������Co2+��Li+ �� ���루NH4��2C2O4��Һ��Ŀ����ʹCo2+ת��Ϊ�����ܳ��������Դ��ǣ�Co2+��Li+��ʹCo2+ת��Ϊ�����ܳ�������5���������Ϸ�����������l���������ǹ��ˣ������ܸ��±�������Co2O3 �� ʵ�����и��±���ʹ�õ�������������
���Դ��ǣ����ˣ�d����6��Li2CO3����ˮ���ܽ�����¶����߶����ͣ�Ϊ����Li2CO3���ܽ���ʧ������Ũ���������ȹ��ˣ�90��ʱc��Li2CO3����Ũ��Ϊ0.10mol/L����c��Li+��=0.20mol/L��c��CO32����=0.10mol/L����Ksp��Li2CO3��=0.20��0.20��0.10=4.0��10��3 ��
���Դ��ǣ�����Li2CO3���ܽ���ʧ��4.0��10��3 ��


 һ���㶨ϵ�д�
һ���㶨ϵ�д� ��У��ҵ��ϵ�д�
��У��ҵ��ϵ�д� ���ɶ���ܲ��¿�ֱͨ��Уϵ�д�
���ɶ���ܲ��¿�ֱͨ��Уϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ִ�������ʱ����ʹ���ٹ�·�رգ�����ͣ�ɣ����������з�ɢϵ�е� (����)
A. ��Һ B. ����Һ C. ����Һ D. ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʵ�飺����ͼ1��ʾ��װ����ȡ�����飻�ڽ��������������ʵ�飮���Թ�I�����μ���2mL ����ˮ��4mLŨ���ᡢ2mL 95%���Ҵ���3g�廯�Ʒ�ĩ�����Թܢ���ע������ˮ�����ձ���ע������ˮ�������Թ�I����״̬�����Ӻ���ȴ���Իش��������⣺ 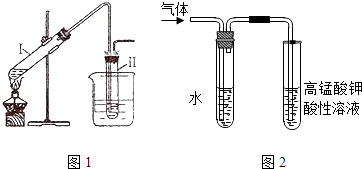
��1���Թ�I��Ũ�������廯�Ƽ��ȷ�Ӧ���������ᣬд�����������Ҵ��ڼ���ʱ��Ӧ�Ļ�ѧ����ʽ
��2��������ķе�ϵͣ��ӷ���Ϊ��ʹ�������������Թܢ��У����ٻӷ���ͼ1�в�ȡ�Ĵ�ʩ����
��3���ڽ�����������NaOH�Ҵ���Һ���ȵ�����ʵ��ʱ�������ɵ�����ͨ��ͼ2��ʾ��װ�ã�����ͼ2װ�ý���ʵ���Ŀ������ͼ���ұ��Թ��е���������ˮ�������� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Һ��Cl�������ʵ���Ũ�������ǣ� ��
A. 1000mL2.5molL��1 NaCl��ҺB. 200mL2molL��1MgCl2��Һ
C. 250mL1molL��1AlCl3��ҺD. 300mL5molL��1FeCl3��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����BaCl2��NaCl�Ļ����ҺaL,�������ֳ����ݡ�һ�ݵμ�ϡ���ᣬʹBa2+������ȫ��������һ�ݵμ�AgNO3��Һ��ʹCl-������ȫ��������Ӧ������xmolH2SO4 ��ymol AgNO3��Һ���ݴ˵�֪ԭ���Һ���Ȼ��Ƶ����ʵ���Ũ��(mol/L)Ϊ�� ��
A. (2y-4x)/a B. (y-x)/aC. (y-2x)/a D. (2y-2x)/a
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����е��뷽��ʽ����ȷ���ǣ� ��
A.��������ˮ��CH3COOH�TCH3COO��+H+
B.Na2SO4����ˮ��Na2SO4�T2Na++SO42��
C.̼����������ˮ��NaHCO3�THCO3��+Na+
D.����������ˮ��HClOH++ClO��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڿ��淴Ӧ��2A��g��+B��g��2C��g����H��0�����и�ͼ����ȷ���ǣ� ��
A.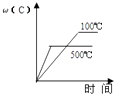
B.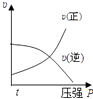
C.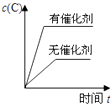
D.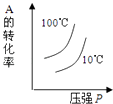
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ɫ��Һ�п��ܴ������������������ ��
A. Na+��NO3-��K+��Fe2+ B. Cu2+��Na+��SO42-��K+
C. K+��I-��NO3-��Ca2+ D. OH-��NO3-��Na+��HCO3-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��HIO4��Ҫ��H5IO6��ʽ���ڣ�H5IO6�ǰ�ɫ���壬������ˮ�����к�ǿ�������ԣ���ǿ����Һ��������Mn2+��
(1)����ɲ���ƽ�������ӷ�Ӧ��
__________Mn2++________H5IO6![]() __________
__________![]() +________
+________![]() +________H++________
+________H++________
(2)�����������ӷ���ʽ�ж�H5IO6��________��������(��ס����ѡ�)��
(3)������Ӧ����������Ԫ����________(��Ԫ�ط���)����1 mol Mn2+�μӷ�Ӧʱ��ת�Ƶ��ӵ����ʵ���Ϊ________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com