
【题目】下面的排序不正确的是
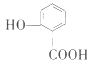
A. 晶体的熔点:![]() >
>
B. 晶格能的大小: Al2O3>MgCl2>NaCl
C. 共价键的键长: F-F>C-Cl>C-S>Si-O
D. 硬度由大到小:金刚石>氮化硅>晶体硅
【答案】C
【解析】
A. 邻羟基苯甲酸形成分子内氢键,对羟基苯甲酸形成分子间氢键。分子间氢键熔沸点大于分子内氢键沸点,故A正确;
B.离子半径Al3+<Mg2+<Na+,O2-<Cl-,且Al3+所带电荷最多,离子电荷数越高、距离越近,晶格能越大,离子半径越大,晶格能越小,故B正确;
C.Cl原子半径小于S原子半径,所以键长 C-Cl<C-S,F原子半径小于C原子半径,F原子半径小于Cl原子半径,键长F-F<C-Cl,故C错误;
D.金刚石中存在C—C共价键,氮化硅中存在Si—N共价键,晶体硅中存在Si—Si共价键,其中键长C—C<Si—N<Si—Si,键长越小,键能越大,形成的晶体硬度越大,故D正确。
故选C。


科目:高中化学 来源: 题型:
【题目】已知X为一种常见酸的浓溶液,能使蔗糖变黑。A与X反应的转化关系如图所示,其中反应条件及部分产物均已略去,则下列有关说法正确的是

A. X使蔗糖变黑的现象主要体现了X的脱水性
B. 若A为铁,则足量A与X在室温下即可完全反应
C. 若A为碳单质,则将C通入少量的澄清石灰水中,一定可以观察到白色沉淀产生
D. 工业上,B转化为D的反应条件为高温、高压、使用催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对甲基苯乙烯(![]() )是有机合成的重要原料。下列对其结构与性质的推错误的是( )
)是有机合成的重要原料。下列对其结构与性质的推错误的是( )
A. 分子式为![]()
B. 能发生加聚反应和氧化反应
C. 具有相同官能团的芳香烃同分异构体有5种![]() 不考虑立体异构
不考虑立体异构![]()
D. 分子中所有原子可能处于同一平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属磷化物(如璘化锌)是常用的蒸杀虫剂。我国卫生部门规定:粮食中化物(以PH3计)的含量不超过0.050mg:kg-1时,粮食质量方达标。现设计测定粮食中残留磷化物含量的实验如下
(资料查阅)磷化锌易水解产生PH3;PH3沸点为-88℃,有剧毒性、强还原性、易自然。
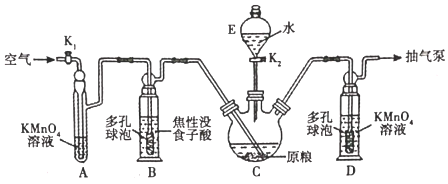
(用量标准]如图:装置A、B、E中盛有的试剂均足量;C中装有100原粮;D中盛有40.00mL6.0×10-5molL-1KMnO4溶液(H2SO4酸化)。
(操作流程)安装仪器并检査气密性→PH、的产生与吸收一转移KMnO4吸收溶液→用Na2SO3标准溶液滴定。
试回答下列问题:
(1)仪器E的名称是______;仪器B、D中进气管下端设计成多孔球泡形状,目的是______。
(2)A装置的作用是______;B装置的作用是吸收空气中的O2,防止______。
(3)下列操作中,不利于精确測定出实验结果的是______(选填序号)。
a.实验前,将C中原粮预先磨碎成粉末
b.将蒸馏水预先煮沸、迅速冷却并注入E中
c.实验过程中,用抽气泵尽可能加快抽气速率
(4)弹化锌发生水解反应时除产生PH3外,还生成______(填化学式)。
(5)D中PH3被氧化成H3PO4,该反应的离子方程式为______。
(6)把D中吸收液转移至容量瓶中,加水稀释至250.00mL,取25.00mL于锥形瓶中,用5.0×10-5molL-1的Na2SO3标准溶液滴定剩余的KMnO4溶液,消耗Na2SO3标准溶液10.00mL.则该原粮中磷化物(以PH3计)的含量为______mgkg-1,该原粮质量______(填“达标”或“不达标“)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是( )
A. Ca(CH3COO)2溶液与硫酸反应:Ca2++SO42-=CaSO4↓
B. Cl2与热的NaOH溶液反应:Cl2+6OH-![]() Cl-+ClO3-+3H2O
Cl-+ClO3-+3H2O
C. 电解K2MnO4碱性溶液制KMnO4:2MnO42-+2H+![]() 2MnO4-+H2↑
2MnO4-+H2↑
D. NaHCO3与过量Ba(OH)2溶液反应:HCO3-+Ba2++OH-=BaCO3↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值,下列说法中正确的是
A. 28g晶体硅中含有Si—Si键的个数为2NA
B. 12g石墨晶体中含有C—C键的个数为3NA
C. 31g白磷中含有P—P键的个数为NA
D. SiO2晶体中1molSi可与O形成2NA个共价键(Si—O键)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用CO2重整CH4制合成气的反应为CO2(g)+CH4(g)![]() 2CO(g)+2H2(g);ΔH>0。在容积均为2.0 L的四个恒容密闭容器中,按不同方式投料(如下表所示),测得反应的相关数据如下:
2CO(g)+2H2(g);ΔH>0。在容积均为2.0 L的四个恒容密闭容器中,按不同方式投料(如下表所示),测得反应的相关数据如下:
容器 | 温度/℃ | 物质的起始物质的量/mol | 物质的平衡物质的量/mol | |||
n(CO2) | n(CH4) | n(CO) | n(H2) | n(H2) | ||
Ⅰ | T1 | 0 | 0.8 | 0.8 | 0.8 | 0.6 |
Ⅱ | T1 | 1.2 | 1.2 | 1.2 | 1.2 | / |
Ⅲ | T2 | 1.0 | 2.0 | 0 | 0 | 1.0 |
Ⅳ | T2 | 0.5 | 1.0 | 0 | 0 | / |
下列说法正确的是( )
A. T1>T2
B. 容器Ⅱ起始时的反应速率:v(正)>v(逆)
C. 容器Ⅰ、Ⅲ达到平衡时,容器内气体总压强之比:p(Ⅰ)∶p(Ⅲ) =11∶20
D. 容器Ⅲ中CO2的平衡转化率比容器Ⅳ中的小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝土矿的主要成分是Al2O3,含有杂质SiO2、Fe2O3、MgO。工业上从铝土矿中提取铝可采用如下工艺流程:

请回答下列问题:
(1)玻璃中含有B,刻蚀玻璃的化学方程式为___。
(2)沉淀C的成分是___,溶液D中存在较多的阴离子是___。
(3)步骤③所加入的试剂是___,生成沉淀F的离子方程式是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环保、安全的铝—空气电池的工作原理如下图所示,下列有关叙述错误的是
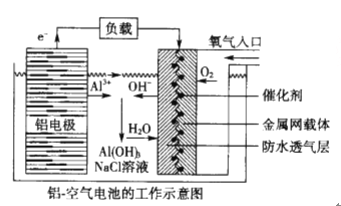
A. NaCl的作用是增强溶液的导电性
B. 正极的电极反应式为: O2+4e-+2H2O=4OH-
C. 电池工作过程中,电解质溶液的pH不断增大
D. 用该电池做电源电解KI溶液制取1molKIO3,消耗铝电极的质量为54g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com