



科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| 操作 | 现象 | |
| 甲 | 向Ⅰ中加入必要的试剂,并向Ⅳ中加入KI、淀粉溶液.连接Ⅰ、Ⅳ,打开活塞 | Ⅰ中剧烈反应,产生无色气体并伴随大量白雾;Ⅳ中有气泡冒出,溶液迅速变蓝 |
| 乙 | 向Ⅱ中加入必要的试剂,并向Ⅳ中加入KI、淀粉溶液和稀硫酸.连接Ⅱ、Ⅳ,点燃酒精灯 | Ⅳ中有气泡冒出,溶液变蓝 |
操作 | 现象 | |
丙 | 向Ⅰ中加入Na2CO3和稀硫酸,Ⅳ中加入KI、淀粉溶液并在上层覆盖少量煤油,使Ⅰ中发生反应.将装置中空气排尽后,再将气体通入Ⅳ的溶液中 | Ⅳ中有气泡冒出,溶液不变蓝 |
丁 | 向Ⅰ中加入Na2CO3和稀硫酸,Ⅲ中加入必要试剂,Ⅳ中加入KI、淀粉溶液.依次连接Ⅰ、Ⅲ、Ⅳ,打开活塞 | Ⅳ中有气泡冒出,溶液变蓝 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| | 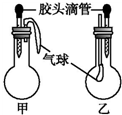 | 甲 | 乙 | |||
| A | 滴管中 | 烧瓶中 | 滴管中 | 烧瓶中 | ||
| B | ||||||
| 水 | 过氧化钠 | 饱和碳酸氢钠溶液 | CO2 | |||
| C | ||||||
| 水 | 钠 | 碳酸钠溶液 | CO2 | |||
| D | ||||||
| 水 | 氧化钠 | NaOH溶液 | CO2 | |||
| 稀盐酸 | 碳酸氢钠 | NaOH溶液 | CO | |||
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

| 实验编号 | 实验目的 | t℃ | 催化剂 | 浓度 |
| 甲组实验Ⅰ | 做实验参照 | 25 | 3滴FeCl3溶液 | 10ml 2% H2O2 |
| 甲组实验Ⅱ | 25 | 10ml 5% H2O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com