
 下表是元素周期表的一部分,表中所列的字母分别代表某一化学元素。用元素符号或化学式回答下列问题:
下表是元素周期表的一部分,表中所列的字母分别代表某一化学元素。用元素符号或化学式回答下列问题:
(1)这些元素中,金属性最强的是 。
(2)a、b、d、g元素的氢化物中,最稳定的是 。
(3)f、a、d三种元素原子半径由大到小的顺序排列为 。
(4)a与d形成的化合物X是大气成分之一,X的电子式是 。
(5)h、Y两元素原子次外电子层上的电子数相等,h与Y形成的化合物在水溶液中能电离出电子层结构相同的离子,则Y元素的符号可能是 、 。
(6)b、h两元素形成的化合物分子中各原子最外层都达到8电子稳定结构,该物质遇水剧烈反应,生成两种产物,其中之一水溶液显碱性,另一种物质具有漂白性,其反应的化学方程式为 。
[s1]26.
 优等生题库系列答案
优等生题库系列答案 53天天练系列答案
53天天练系列答案科目:高中化学 来源: 题型:
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/mol?L-1 | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
| c(CO)/mol?L-1 | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
| c(N2)c2(CO2) |
| c2(CO)c2(NO) |
| c(N2)c2(CO2) |
| c2(CO)c2(NO) |
查看答案和解析>>
科目:高中化学 来源:2013-2014学年东北三省四市高三第一次模拟考试理综化学试卷(解析版) 题型:填空题
2013年初,全国各地多个城市都遭遇“十面霾伏”,造成“阴霾天”的主要根源之一是汽车尾气和燃煤尾气排放出来的固体小颗粒。
汽车尾气净化的主要原理为:2NO(g)+2CO(g)  2CO2+N2。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线如下图所示。据此判断:
2CO2+N2。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线如下图所示。据此判断:

(1)该反应为 反应(填“放热”或“吸热”):在T2温度下,0~2s内的平均反应速率:v(N2)= ;(2)当固体催化剂的质量一定时,增大其表面积可提高化学反应速率。若催化剂的表面积S1>S2,在答题卡上画出 c(CO2)在T1、S2条件下达到平衡过程中的变化曲线。
(3)某科研机构,在t1℃下,体积恒定的密闭容器中,用气体传感器测得了不同时间的NO和CO的浓度(具体数据见下表,CO2和N2的起始浓度为0)。
|
时间/s |
0 |
1 |
2 |
3 |
4 |
5 |
|
c(NO)/xl0-4 mol L-1 |
10.0 |
4.50 |
2.50 |
1.50 |
1.00 |
1.00 |
|
c(CO)/xl0-3 mol L-1 |
3.60 |
3.05 |
2.85 |
2.75 |
2.70 |
2.70 |
t1℃时该反应的平衡常数K= ,平衡时NO的体积分数为 。
(4)若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是 (填代号)。(下图中v正、K、n、m分别表示正反应速率、平衡常数、物质的量和质量)

(5)煤燃烧产生的烟气也含氮的氧化物,用CH4催化还原NOX可以消除氮氧化物的污染。
已知:CH4(g)+2NO2(g) = N2 (g)+CO2 (g)+2H2O(g) △H=-867.0 kJ • mol-1
2NO2 (g) 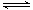 N2O4
(g)
△H=-56.9 kJ • mol-1
N2O4
(g)
△H=-56.9 kJ • mol-1
H2O(g) = H2O(l) △H=-44.0 kJ • mol-1
写出CH4催化还原N2O4 (g)生成N2 (g)、CO2 (g)和H2O(l)的热化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
[s1]
 下表是元素周期表的一部分,表中所列的字母分别代表某一化学元素。用元素符号或化学式回答下列问题:
下表是元素周期表的一部分,表中所列的字母分别代表某一化学元素。用元素符号或化学式回答下列问题:
(1)这些元素中,金属性最强的是 。
(2)a、b、d、g元素的氢化物中,最稳定的是 。
(3)f、a、d三种元素原子半径由大到小的顺序排列为 。
(4)a与d形成的化合物X是大气成分之一,X的电子式是 。
(5)h、Y两元素原子次外电子层上的电子数相等,h与Y形成的化合物在水溶液中能电离出电子层结构相同的离子,则Y元素的符号可能是 、 。
(6)b、h两元素形成的化合物分子中各原子最外层都达到8电子稳定结构,该物质遇水剧烈反应,生成两种产物,其中之一水溶液显碱性,另一种物质具有漂白性,其反应的化学方程式为 。
[s1]26.
查看答案和解析>>
科目:高中化学 来源:广西省桂林中学2010-2011学年高三年级8月月考化学 题型:填空题
[s1] 几种短周期元素的原子半径及其某些化合价见下表:
|
元素代号 |
A |
B |
D |
E |
G |
H |
I |
J |
|
常见化合价 |
-1 |
-2 |
+4、-4 |
+6、+4、-2 |
+5、-3 |
+3 |
+2 |
+1 |
|
原子半径/pm |
64 |
66 |
77 |
104 |
110 |
143 |
160 |
186 |
分析上表中有关数据,并结合已学过的知识,回答以下问题,涉及上述元素的答案,请用元素符号表示。
(1)E元素在周期表中位于 周期, 族。
(2) A、H、J对应离子的半径由大到小的顺序是(填离子符号)_______________________________。
(3)A与I所形成的化合物的晶体类型是 。
(4)DB2的电子式__________ 。
(5)D的最高价氧化物与J的最高价氧化物对应水化物X的溶液(足量)发生反应的离子方程式 。
[s1]22.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com