
【题目】下列说法中不正确的是( )
A. 含金属元素的离子不一定是阳离子 B. 金属原子只有还原性
C. 元素由化合态变为游离态一定被氧化 D. 金属阳离子被还原不一定得到金属单质
【答案】C
【解析】
A.含金属元素的离子不一定是阳离子,也可能是阴离子,如高锰酸根离子MnO4-中含有金属元素锰,它是阴离子,A项正确;
B.因为金属元素没有负价,金属原子在反应中只能失去电子转化为正化合价,只表现还原性,B项正确;
C.元素由化合态变为游离态可能被氧化,也可能被还原,如浓盐酸中氯元素被MnO2氧化成Cl2:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,CuCl2中铜元素被Fe还原为Cu:CuCl2+Fe=Cu+FeCl2,C项错误;
MnCl2+Cl2↑+2H2O,CuCl2中铜元素被Fe还原为Cu:CuCl2+Fe=Cu+FeCl2,C项错误;
D.金属阳离子被还原不一定得到金属单质,如Fe3+能被Fe还原生成Fe2+,2Fe3++Fe=3Fe2+,D项正确;答案选C。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】同温同压下,质量相同的CO2、O2、CH4三种气体,下列说法错误的是
A. 所占的体积由大到小的顺序是:CH4>O2>CO2
B. 所含分子数由多到少的顺序是:CH4>O2>CO2
C. 密度由大到小的顺序是:CO2>O2>CH4
D. 所含的电子数由多到少是:CO2>CH4>O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,氧化剂与还原剂的物质的量之比为1:2的是
①2CH3COOH+Ca(C1O)2=2HC1O+Ca(CH3COO)2
② SiO2+2C![]() Si+2CO↑
Si+2CO↑
③4HC1(浓)+MnO2![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
④SiO2+3C![]() SiC+2CO↑
SiC+2CO↑
A. 仅有② B. 仅有②④ C. 仅有②③④ D. ①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某二次电池充、放电的化学方程式为2K2S2+KI3![]() K2S4+3KI,其与充电其他设备连接的电路如图所示。当闭合开关K时,电极X附近溶液先变红。则下列说法正确的是
K2S4+3KI,其与充电其他设备连接的电路如图所示。当闭合开关K时,电极X附近溶液先变红。则下列说法正确的是
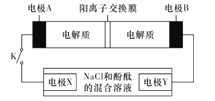
A. 放电时,电极A发生还原反应
B. 电极A的电极反应式为3I--2e-=I3-
C. 当有0.1mol K+通过阳离子交换膜时,电极X上产生气体1.12 L(标准状况下)
D. 电池充电时,电极B要与外电源的正极相连,电极上发生还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄铜矿是工业炼铜的主要原料,主要成分为CuFeS2,含少量脉石。为测定该黄铜矿的纯度,某同学设计了如下实验:
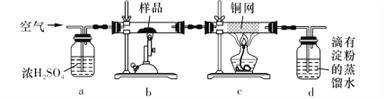
现用电子天平称取研细的黄铜矿样品1.150 g,在空气存在下进行煅烧,生成Cu、Fe3O4和SO2气体,实验后取d中溶液的1/10置于锥形瓶中,用0.05 mol L-1标准碘溶液进行滴定,消耗标准碘溶液20. 00 mL。请回答下列问题:
(1)将样品研细后再进行反应,其目的是_____________________;标准碘溶液应盛放在___________(填“碱式”或“酸式”)滴定管中。
(2) a装置的作用是__________________(填字母代号)。
A.除去空气中的二氧化碳
B.除去空气中的水蒸气
C有利于气体混合
D.有利于观察、控制空气流速
(3)若去掉c装置,会使测定结果_______________(填“偏低”“偏高”或“无影响”),写出影响测定结果的化学方程式:________________________。
(4)上述反应结束后,仍需通一段时间的空气,其目的是___________________________。
(5)通过计算可知,该黄铜矿的纯度为_________________________。
(6) 假设实验操作均正确,测得的黄铜矿纯度仍然偏低,可能的原因主要有_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组拟验证CO2与Na2O2反应的产物,现设计以下实验装置进行实验:

(1)写出装置A中反应的化学方程式________。
(2)写出装置B中反应的化学方程式________。
(3)拟用装置D收集气体产物,请将装置补充完整________。
(4)产物检验:检验气体产物的方法________。
(5)检验固体产物的方法:从B装置中取少量固体,溶于水配成溶液,________。
(6)有同学认为该实验装置存在明显缺陷,你认为该缺陷是什么________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的实验装置图正确且能达到相应实验目的的是
A. 装置除去Cl2中的HCl 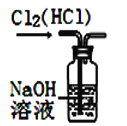
B. 装置实验室制NH3 
C. 装置分离MnO2和KCl 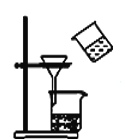
D. 装置蒸干NH4Cl饱和溶液制备NH4Cl晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上利用电解饱和食盐水生产氯气(Cl2)、烧碱和氢气的化学方程式是:2NaCl + 2H2O![]() NaOH + Cl2↑+ H2↑
NaOH + Cl2↑+ H2↑
(1)用双线桥表示出电子转移的方向和数目______________题干中反应改写成离子方程式是___________________________________
(2)电解食盐水的过程中,氧化产物是__________________________________
(3)电解食盐水要求对粗食盐水进行精制,以除去租食盐水中含有的泥沙和SO42-、Ca2+,Mg2+等杂质离子。精制时依次加入氯化钡溶液、纯碱、烧碱,充分反应后过滤,在滤液中加入盐酸中和至中性。盐酸与滤液反应的离子方程式:___________________,________________________________.
(4)实验室欲用固体NaOH来配制90ml 0.5 mol/L的NaOH溶液来用于以上除杂,需要称量固体NaOH_______g。配制时,一般可分为以下几个步骤:①称量 ②计算 ③溶解 ④摇匀 ⑤转移 ⑥洗涤 ⑦定容 ⑧冷却。其正确的操作顺序为__________。在配制过程中,若其它操作均正确,下列操作会引起结果偏低的是___________(填字母)。
A.没有洗涤烧杯和玻璃棒
B.未等NaOH溶液冷却至室温就转移到容量瓶中定容
C.容量瓶不干燥,含有少量蒸馏水
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com