
| ŌŖĖŲ | Ļą¹ŲŠÅĻ¢ |
| A | ¼ņµ„Ēā»ÆĪļÄÜÓėĘä×īøß¼Ūŗ¬ŃõĖį·“Ӧɜ³ÉŃĪ |
| B | Ō×Ó×īĶā²ćµē×ÓŹżŹĒĘäµē×Ó²ćŹżµÄ3±¶ |
| C | ÖÜĘŚ±ķÖŠ·Ē½šŹōŠŌ×īĒæµÄŌŖĖŲ |
| D | ÓėCĪ»ÓŚĶ¬Ö÷×壬ĒŅ¶¼ĪŖ¶ĢÖÜĘŚŌŖĖŲ |
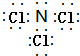 £®X³£ÓĆ×÷ĘÆ°×¼Į£¬Ņ²ÓĆÓŚÄūĆŹµČĖ®¹ūµÄѬÕō“¦Ąķ£®ŅŃÖŖ»ÆŗĻĪļXÖŠ£¬AĻŌøŗ¼Ū£¬DĻŌÕż¼Ū£¬ŌņøĆ»ÆŗĻĪļÓėĖ®·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖNCl3+4H2O=NH3£®H2O+3HClO£®
£®X³£ÓĆ×÷ĘÆ°×¼Į£¬Ņ²ÓĆÓŚÄūĆŹµČĖ®¹ūµÄѬÕō“¦Ąķ£®ŅŃÖŖ»ÆŗĻĪļXÖŠ£¬AĻŌøŗ¼Ū£¬DĻŌÕż¼Ū£¬ŌņøĆ»ÆŗĻĪļÓėĖ®·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖNCl3+4H2O=NH3£®H2O+3HClO£® ·ÖĪö A”¢B”¢C”¢DŹĒ¶ĢÖÜĘŚÖŠŌ×ÓŠņŹżŅĄ“ĪŌö“óµÄŌŖĖŲ£¬AµÄ¼ņµ„Ēā»ÆĪļÄÜÓėĘä×īøß¼Ūŗ¬ŃõĖį·“Ӧɜ³ÉŃĪ£¬ŌņAĪŖNŌŖĖŲ£»BŌ×Ó×īĶā²ćµē×ÓŹżŹĒĘäµē×Ó²ćŹżµÄ3±¶£¬Ō×ÓÖ»ÄÜÓŠ2øöµē×Ó²ć£¬×īĶā²ćµē×ÓŹżĪŖ6£¬ŌņBĪŖOŌŖĖŲ£»CŹĒÖÜĘŚ±ķÖŠ·Ē½šŹōŠŌ×īĒæµÄŌŖĖŲ£¬ŌņCĪŖFŌŖĖŲ£»DÓėCĪ»ÓŚĶ¬Ö÷×壬ĒŅ¶¼ĪŖ¶ĢÖÜĘŚŌŖĖŲ£¬ŌņDĪŖCl£¬¾Ż“Ė½ā“š£®
½ā“š ½ā£ŗA”¢B”¢C”¢DŹĒ¶ĢÖÜĘŚÖŠŌ×ÓŠņŹżŅĄ“ĪŌö“óµÄŌŖĖŲ£¬AµÄ¼ņµ„Ēā»ÆĪļÄÜÓėĘä×īøß¼Ūŗ¬ŃõĖį·“Ӧɜ³ÉŃĪ£¬ŌņAĪŖNŌŖĖŲ£»BŌ×Ó×īĶā²ćµē×ÓŹżŹĒĘäµē×Ó²ćŹżµÄ3±¶£¬Ō×ÓÖ»ÄÜÓŠ2øöµē×Ó²ć£¬×īĶā²ćµē×ÓŹżĪŖ6£¬ŌņBĪŖOŌŖĖŲ£»CŹĒÖÜĘŚ±ķÖŠ·Ē½šŹōŠŌ×īĒæµÄŌŖĖŲ£¬ŌņCĪŖFŌŖĖŲ£»DÓėCĪ»ÓŚĶ¬Ö÷×壬ĒŅ¶¼ĪŖ¶ĢÖÜĘŚŌŖĖŲ£¬ŌņDĪŖCl£®
£Ø1£©BŌŖĖŲĪŖOŌŖĖŲ£¬Bµ„ÖŹÓėNa¾ēĮŅ·“Ӧɜ³ÉµÄ»ÆŗĻĪļĪŖNa2O2£¬ŗ¬ÓŠĄė×Ó¼ü”¢¹²¼Ū¼ü£¬
¹Ź“š°øĪŖ£ŗO£»Ąė×Ó¼ü”¢¹²¼Ū¼ü£»
£Ø2£©·śĘųÖŹÓėĖ®·“Ó¦æɲśÉśŹ¹“ųÓą½żµÄľĢõø“Č¼µÄĘųĢ壬ĖµĆ÷Éś³ÉŃõĘų£¬øĆ·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ£ŗ2F2+2H2O=4HF+O2£¬
¹Ź“š°øĪŖ£ŗ2F2+2H2O=4HF+O2£»
£Ø3£©ÓÉN”¢ClĮ½ÖÖŌŖĖŲ×é³ÉµÄŅ»ÖÖ»ÆŗĻĪļX·Ö×ÓÖŠ£¬ĖłÓŠŌ×ÓµÄ×īĶā²ć¾ł“ļµ½8µē×ÓĪČ¶Ø½į¹¹£¬ŌņXĪŖNCl3£¬µē×ÓŹ½ĪŖ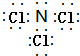 £¬NCl3³£ÓĆ×÷ĘÆ°×¼Į£¬»ÆŗĻĪļNCl3ÖŠ£¬NĻŌøŗ¼Ū£¬ClĻŌÕż¼Ū£¬ŌņøĆ»ÆŗĻĪļÓėĖ®·“Ӧɜ³ÉNH3£®H2OÓėHClO£¬»Æѧ·½³ĢŹ½ĪŖ£ŗNCl3+4H2O=NH3£®H2O+3HClO£¬
£¬NCl3³£ÓĆ×÷ĘÆ°×¼Į£¬»ÆŗĻĪļNCl3ÖŠ£¬NĻŌøŗ¼Ū£¬ClĻŌÕż¼Ū£¬ŌņøĆ»ÆŗĻĪļÓėĖ®·“Ӧɜ³ÉNH3£®H2OÓėHClO£¬»Æѧ·½³ĢŹ½ĪŖ£ŗNCl3+4H2O=NH3£®H2O+3HClO£¬
¹Ź“š°øĪŖ£ŗ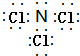 £»NCl3+4H2O=NH3£®H2O+3HClO£®
£»NCl3+4H2O=NH3£®H2O+3HClO£®
µćĘĄ ±¾Ģāæ¼²é½į¹¹ŠŌÖŹĪ»ÖĆ¹ŲĻµÓ¦ÓĆ£¬ĶʶĻŌŖĖŲŹĒ½āĢā¹Ų¼ü£¬£Ø3£©ÖŠ·½³ĢŹ½×¢ŅāĄūÓĆĖ®½ā¹ęĀɏ銓£®


 ĆūŹ¦Öøµ¼ĘŚÄ©³å“Ģ¾ķĻµĮŠ“š°ø
ĆūŹ¦Öøµ¼ĘŚÄ©³å“Ģ¾ķĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
 °±ĘųŅ×Ņŗ»Æ£¬±ćÓŚ“¢ŌĖ£¬æÉĄūÓĆNH3×÷“¢Ēā²ÄĮĻ
°±ĘųŅ×Ņŗ»Æ£¬±ćÓŚ“¢ŌĖ£¬æÉĄūÓĆNH3×÷“¢Ēā²ÄĮĻ²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® |  | B£® |  | C£® |  | D£® |  |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ÕżĻņŅĘ¶Æ | B£® | ÄęĻņŅĘ¶Æ | C£® | “ļµ½Ę½ŗā | D£® | ²»Ņ»¶Ø |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | HCO3- | B£® | Cl- | C£® | NH4+ | D£® | Cu2+ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
 £©µÄĻĀĮŠĖµ·Ø²»ÕżČ·µÄŹĒ£Ø””””£©
£©µÄĻĀĮŠĖµ·Ø²»ÕżČ·µÄŹĒ£Ø””””£©| A£® | ÄÜŹ¹äåĖ®ĶŹÉ« | B£® | ŗĖ“Ź²ÕńĒāĘ×ÓŠ4×é·å | ||
| C£® | ÄÜŃõ»ÆĪŖ¶žŌŖČ© | D£® | ÄÜ·¢Éś¼Ó³É”¢ĻūČ„¼°Ņų¾µ·“Ó¦ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com