
工业上利用电解饱和食盐水可制得重要化工产品,又称为“氯碱工业”。并能以它们为原料生产一系列化工产品。为提高原料的利用率,节能降耗。设计如图所示工艺流程,其中氯碱工业装置中的电极未标出。
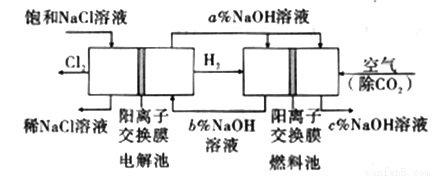
(1)电解饱和食盐水的化学方程式为___________________。
(2)为除去粗盐中的Ca2+、Mg2+、SO42-及泥沙,得到纯净的NaCl,可将粗盐溶于水,正确的操作步骤的顺序是_______ (填序号)。
①过滤②加过量NaOH溶液③加适量盐酸④加过量Na2CO3溶液⑤加过量BaCl2溶液
A.①④①②⑤③ B.①②⑤④①③ C.①②④⑤③ D.④②⑤
(3)图中NaOH溶液的质量分数a%、b%、c%,由大到小的顺序为_________。
(4)氯碱工业的产物NaOH与不同物质反应可以生成不同的盐。已知常温下,浓度均为0.1 mol/L的四种钠盐溶液pH如下表,下列说法不正确的是_______(填序号)。
溶质 | Na2CO3 | NaHCO3 | NaClO | NaHSO3 |
pH | 11.6 | 9.7 | 10.3 | 5.2 |
A.向氯水中加入NaHCO3,可以增大氯水中次氯酸的浓度
B.四种溶液中,水的电离程度最大的是NaClO
C.常温下,相同物质的量浓度的H2SO3、H2CO3、HClO,pH最大的是HClO
D.四种盐的阴离子结合H+能力最强的是HCO3-
(5)若利用电解氯化钠溶液所得的气体制36.5%的浓盐酸100t,最少需要消耗食盐_________t。
(6)氯碱工业产品Cl2可用于冶炼钛铁矿得到金属钛,流程如图。写出钛铁矿经氯化法得到四氯化钛的化学方程式:____________________。
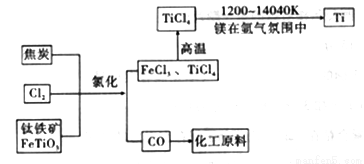
(7)氮气和氩气是两种化学性质相对稳定的气体。镁还原TiCl4的反应中为防止Mg和Ti被氧化选择稀有气体氩气。试用化学反应方程式解释不选用氮气的原因:__________________。
 导学全程练创优训练系列答案
导学全程练创优训练系列答案科目:高中化学 来源:2016-2017学年江苏省高二学业水平测试化学试卷(解析版) 题型:选择题
下列气体可用下图所示方法收集的是

A. NO2 B. O2 C. SO2 D. NH3
查看答案和解析>>
科目:高中化学 来源:2017届黑龙江省哈尔滨市高三二模理科综合化学试卷(解析版) 题型:选择题
用下列实验装置进行相应实验,能达到实验目的的是
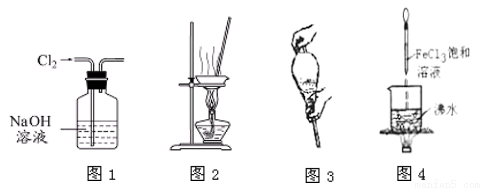
A. 用图1所示装置除去Cl2中含有的HCl
B. 用图2所示装置蒸干MgCl2饱和溶液制备MgCl2·6H2O晶体
C. 用环己烷萃取碘水时将两者混合后需如图3所示用力振荡
D. 继续煮沸图4所示溶液至红褐色,停止加热,当光束通过体系时可产生丁达尔效应
查看答案和解析>>
科目:高中化学 来源:2017届陕西省高三下学期周练(四)理科综合化学试卷(解析版) 题型:实验题
铁是人类较早使用的金属之一,铁及其化合物在现代社会各个领域仍有广泛的应用。
I.氧化物—Fe2O3:用工业FeCl3粗品(含Ca、Mn、Cu等杂质离子)制取高纯铁红,实验室常用萃取剂X(甲基异丁基甲酮)萃取法制取高纯铁红的主要实验步骤如下:

已知:HCl(浓) + FeCl3 HFeCl4 。试回答下列问题:
HFeCl4 。试回答下列问题:
(1)用萃取剂X萃取,该步骤中:
① Ca2+、Mn2+、Cu2+等杂质离子主要在__________(填“水”或“有机”)相。
② 若实验时共用萃取剂X 150mL,萃取率最高的方法是__________(填字母)。
a.一次性萃取,150mL b.分2次萃取,每次75mL c.分3次萃取,每次50mL
(2)用高纯水反萃取,萃取后水相中铁的存在形式是________________(写化学式);反萃取能发生的原因是___________________。
(3)所得草酸铁沉淀需用冰水洗涤,其目的一是洗去沉淀表面吸附的杂质离子,二是________________。
(4)测定产品中铁的含量需经酸溶、还原为Fe2+,然后在酸性条件下用标准K2Cr2O7溶液滴定,已知铬的还原产物为Cr3+,写出该滴定反应的离子方程式 ___________________。
II.含氧酸盐—铁酸铜(CuFe2O4)是很有前景的热化学分解水制氢的材料,CuFe2O4在制氢过程中可以循环使用。在热化学循环分解水制氢的过程中,铁酸铜(CuFe2O4)先要煅烧成氧缺位体(CuFe2O4-a),氧缺位值(a)越大,活性越高,制氢越容易。
(5)根据以上提示,写出氧缺位体与水常温下反应制氢的化学方程式____________。
(6)课外小组将铁酸铜样品在N2的气氛中充分煅烧,得氧缺位体的质量为原质量的96.6%,则氧缺位值(a)=__________。(结果保留小数点后2位)
查看答案和解析>>
科目:高中化学 来源:2017届陕西省高三下学期周练(四)理科综合化学试卷(解析版) 题型:选择题
设NA表示阿伏加德罗常数,下列叙述正确的是
A.在密闭容器中加入0.5moLN2和1.5moLH2,充分反应后容器中的N—H键数为3NA
B.标准状况下,2.24 LHF中含有的原子数为0.2 NA
C.71 g氯气与足量铁反应得到的电子数一定为2NA
D.电解饱和食盐水时,当阴极产生H2 22.4L时,电路中转移的电子数为2NA
查看答案和解析>>
科目:高中化学 来源:2017届贵州省贵阳市高三下学期第六次适应性考试理综化学试卷(解析版) 题型:选择题
应用下列实验装置进行实验,能达到目的的是

A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二下学期第一次月考化学试卷(解析版) 题型:选择题
下列各组物质中,X是主体物质,Y是少量物质,Z是为除去杂质所要加入的试剂,其中所加试剂正确的一组是( )
A | B | C | D | |
X | FeCl2溶液 | FeCl3溶液 | Al | Na2SO4溶液 |
Y | FeCl3 | CuCl2 | Fe | Na2CO3 |
Z | Fe | Fe | NaOH溶液 | BaCl2溶液 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二下学期第一次月考化学试卷(解析版) 题型:选择题
将一定体积的SO3(g)充入恒容的密闭容器中,发生反应2SO3(g) 2SO2(g)+O2(g)并达到平衡;保持温度不变,再充入相同体积的SO3(g),达到新平衡后,与原平衡相比,下列值减小的是 ( )
2SO2(g)+O2(g)并达到平衡;保持温度不变,再充入相同体积的SO3(g),达到新平衡后,与原平衡相比,下列值减小的是 ( )
A.平均相对分子质量 B.SO3(g)的转化率
C.c(SO3)/c(SO2) D.c2(SO3)/[c2(SO2)·c(O2)]
查看答案和解析>>
科目:高中化学 来源:2017届天津市高三下学期第一次月考化学试卷(解析版) 题型:选择题
已知常温下CH3COOH的电离平衡常数为K。该温度下向20 mL 0.1 mol·L-1 CH3COOH溶液中逐滴加入0.1 mol·L-1 NaOH溶液,其pH变化曲线如图所示(忽略温度变化)。下列说法中不正确的是( )
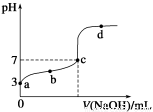
A.a点表示的溶液中c(CH3COO-)略小于10-3 mol·L-1
B.b点表示的溶液中c(CH3COO-)>c(Na+)
C.c点表示CH3COOH和NaOH恰好反应完全
D.b、d点表示的溶液中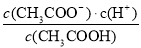 均等于K
均等于K
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com