

分析 (1)根据量热计的构造来判断该装置的缺少仪器、装置的错误;
(2)反应放出的热量和所用酸以及碱的量的多少有关,并根据中和热的概念和实质来回答;
(3)根据实验的关键是保温,如果装置有能量散失,则会导致结果偏低,根据实验中用到的试剂以及实验操作知识来判断;
(4)考虑中和反应是放热反应;当酸碱恰好反应时,放出的热量最高,从图示可知二者体积比,根据反应关系计算氢氧化钠的浓度.
解答 解:(1)根据量热计的构造可知该装置的缺少仪器是环形玻璃搅拌器,装置的错误是:小烧杯口与大烧杯口不相平,且未填满碎塑料泡沫(或碎纸条),
故答案为:环形玻璃搅拌器;小烧杯没有与大烧杯齐平,在大小烧杯间填满碎塑料泡沫(或碎纸条)使小烧杯口与大烧杯口相平;
(2)反应放出的热量和所用酸以及碱的量的多少有关,若用60mL0.50mol/L的盐酸跟50mL 0.55mol/L的NaOH溶液进行反应,与上述实验相比,生成水的量增多,所放出的热量偏高,但是中和热的均是强酸和强碱反应生成1mol水时放出的热,与酸碱的用量无关,所以用60mL0.50mol/L的盐酸跟50mL 0.55mol/L的NaOH溶液反应,测得中和热数值相等;
故答案为:不相等;相等;因为中和热是指酸跟碱发生中和反应生成1molH2O所放出的热量,与酸碱的用量无关;
(3)A.测量盐酸的温度后,温度计没有用水冲洗干净,在测碱的温度时,会发生酸和碱的中和,温度计示数变化值减小,导致实验测得中和热的数值偏小,故A正确;
B、把量筒中的氢氧化钠溶液倒入小烧杯时动作迟缓,会导致一部分能量的散失,实验测得中和热的数值偏小,故B正确;
C、做本实验的室温和反应热的数据之间无关,故C错误;
D、在量取盐酸时仰视计数,会使得实际量取体积高于所要量的体积,放出的热量偏大,导致实验测得中和热的数值偏高,故D错误;
E、将50mL0.55mol/L氢氧化钠溶液取成了50mL0.55mol/L的氨水,由于氨水是弱碱,碱的电离是吸热的过程,所以导致实验测得中和热的数值偏小,故E正确;
故选:ABE;
(4)从图形起点可知:5mLHCl溶液和45mLNaOH溶液反应放热后的温度已经是22℃,则溶液混合前的实验环境温度一定低于22℃;当酸碱恰好反应时,放出的热量最高,从图示可知V1=30mL,V2=50mL-30mL=20mL,二者体积比为:$\frac{V{\;}_{1}}{{V}_{2}}$=$\frac{30}{20}$=$\frac{3}{2}$,c(NaOH)=$\frac{c(HCl)×V{\;}_{1}}{V{\;}_{2}}$=$\frac{1.0mol/L×30mL}{20mL}$=1.5mol/L;
故答案为:低于;1.5.
点评 本题考查了中和热的计算问题,注意从图示得出解题信息是解答本题的关键,并注意中和热的热方程式的书写方法来解答.


 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:多选题
| A. | 离子半径:C>D>A>B | B. | 核电核数:b>a>d>c | ||
| C. | 原子半径:A>B>D>C | D. | 元素的电负性:A>B>C>D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 22.4 L氧气中,一定含有2 mol氧原子 | |
| B. | 80 g NaOH溶解在1 L水中,得到溶液的物质的量浓度为2mol/L | |
| C. | 18 g水在标准状况下的体积约为22.4 L | |
| D. | 标准状况下,20 mL NH3跟60 mL O2所含分子个数比为1:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | NH4NO3固体 | B. | NaOH固体 | C. | CaCl2固体 | D. | NaHSO4固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 元素A、B、C、D、E、F是位于元素周期表前四周期元素,且原子序数依次增大.其中 D、F为常见金属元素;A元素原子核内只有一个质子,元素A与B形成的气态化合物甲在标准状况下的密度为0.759g•L-1,C元素原子的最外层电子数是其电子层数的3倍,E与C同主族,由D或F元素组成的单质或某些离子(或化合物)在溶液中均有下列转化关系(如图,其它参与反应的物质未列出):
元素A、B、C、D、E、F是位于元素周期表前四周期元素,且原子序数依次增大.其中 D、F为常见金属元素;A元素原子核内只有一个质子,元素A与B形成的气态化合物甲在标准状况下的密度为0.759g•L-1,C元素原子的最外层电子数是其电子层数的3倍,E与C同主族,由D或F元素组成的单质或某些离子(或化合物)在溶液中均有下列转化关系(如图,其它参与反应的物质未列出): .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
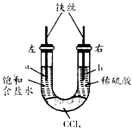 利用如图装置进行实验,开始时,左右两管液面相平,密封好,放置一段时间.下列说法正确的是( )
利用如图装置进行实验,开始时,左右两管液面相平,密封好,放置一段时间.下列说法正确的是( )| A. | 左管中O2得到电子,右管中H+得到电子 | |
| B. | 一段时间后,左管液面低于右管液面 | |
| C. | a、b两处具有相同的电极反应式:Fe-3e-=Fe3+ | |
| D. | a处溶液的pH增大,b处溶液的pH减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com