
| A. | 1molFe溶于过量硝酸,电子转移数为2NA | |
| B. | 1mol O2和2mol SO2反应生成的SO3分子数为2NA | |
| C. | 常温常压下,4.4gCO2与N2O混合气体中含有的原子数为0.3NA | |
| D. | H2O2分解产生1molO2,转移的电子数为4NA |
分析 A、铁和过量的硝酸反应后变为+3价;
B、二氧化硫和氧气的反应为可逆反应;
C、CO2与N2O的摩尔质量均为44g/mol,且均为三原子分子;
D、双氧水分解制取氧气时,氧元素由-1价变为0价.
解答 解:A、铁和过量的硝酸反应后变为+3价,故1mol铁失去3NA个电子,故A错误;
B、二氧化硫和氧气的反应为可逆反应,故不能进行完全,故生成的三氧化硫分子个数小于2NA个,故B错误;
C、CO2与N2O的摩尔质量均为44g/mol,故4.4g混合物的物质的量为0.1mol,且两者均为三原子分子,故0.1mol混合物中含0.3NA个原子,故C正确;
D、双氧水分解制取氧气时,氧元素由-1价变为0价,故当生成1mol氧气时,转移2NA个电子,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意掌握公式的运用和物质的结构.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 水是生命的源泉,工业的血液、城市的命脉,要保护好河流,河水是重要的饮用水源,污染物通过用水直接毒害人体,也可通过食物链和灌溉农田间接危及健康.请问答下列问题:
水是生命的源泉,工业的血液、城市的命脉,要保护好河流,河水是重要的饮用水源,污染物通过用水直接毒害人体,也可通过食物链和灌溉农田间接危及健康.请问答下列问题:| 化学式 | 电离平衡常数(25℃) |
| HCN | K=4.9×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | K1=4.3x10-7,K2=5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl、HBr、HI的热稳定性依次增强 | B. | KOH的碱性比NaOH的碱性强 | ||
| C. | HBrO4酸性比HClO4强 | D. | Na的金属性比Al的弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | △H4=$\frac{2}{3}$ (3△H3-△H1)-△H2 | B. | △H4=$\frac{2}{3}$ (△H1+△H2)+△H3 | ||
| C. | △H4=$\frac{2}{3}$ (△H1+△H2)-△H3 | D. | △H4=$\frac{2}{3}$ (△H1-△H2)-△H3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 铁及其化合物在日常生活、生产中应用广泛,研究铁及其化合物的应用意义重大.回答下列问题:
铁及其化合物在日常生活、生产中应用广泛,研究铁及其化合物的应用意义重大.回答下列问题:| 温度 | 250℃ | 600℃ | 1000℃ | 2000℃ |
| 主要成分 | Fe2O3 | Fe3O4 | FeO | Fe |
| t/min | 0 | 10 | 20 | 30 | 40 | 50 |
| x(CO) | 0.25 | 0.23 | 0.214 | 0.202 | 0.193 | 0.193 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
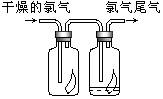 (1)如图所示,将氯气依次通过盛有干燥有色布条的广口瓶和盛有湿润有色布条的广口瓶,可观察到的现象是干燥的有色布条无明显现象,潮湿的有色布条褪色.
(1)如图所示,将氯气依次通过盛有干燥有色布条的广口瓶和盛有湿润有色布条的广口瓶,可观察到的现象是干燥的有色布条无明显现象,潮湿的有色布条褪色.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com