
短周期元素Q、W、X、Y、Z的原子序数依次增大,X元素的颜色反应呈黄色,Q原子的最外层电子数是其内层电子数的2倍,W、Z原子的最外层电子数相同,Z元素的核电荷数是W的2倍,Y是地壳中含量最多的金属元素。下列说法不正确的是 ( )
A.工业上常用电解的方法制备X、Y的单质
B.元素Q和Z能形成QZ2型的共价化合物
C.原子半径的大小顺序:r(X)> r(Y)> r(W)> r(Q)
D.元素X、Y的最高价氧化物对应的水化物之间能发生反应
【答案】C
【解析】
试题分析:根据题意可推知:Q是C;W是O;X是Na;Y是Al;Z是S。A.由于Na、Al都是活泼的金属,所以工业上常用电解的方法制备X、Y的单质,正确;B.元素Q和Z能形成QZ2型的共价化合物CS2,正确;C.同一周期的元素,原子序数越大,原子半径就越小,不同周期的元素,原子核外电子层数越多,原子半径就越大,所以原子半径的大小顺序:r(X)> r(Y) > r(Q) > r(W) ,错误;D.元素X的最高价氧化物对应的水化物是强碱,Y的最高价氧化物对应的水化物是两性氢氧化物,因此它们之间能发生反应,正确。
考点:考查元素的推断及元素与化合物的性质、结构的知识。


 导学与测试系列答案
导学与测试系列答案 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案科目:高中化学 来源: 题型:
金属钛(Ti)性能优越,被称为继铁、铝之后的“第三金属”。工业上以钛铁矿(主要成分FeTiO3,含FeO、Al2O3、SiO2等杂质)为主要原料冶炼金属钛,其生产的工艺流程图如下:
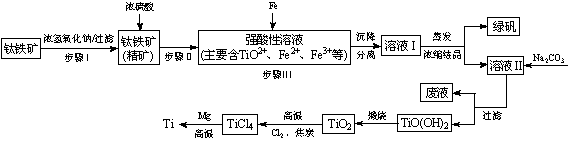
已知:2H2SO4(浓)+ FeTiO3=TiOSO4 + FeSO4 + 2H2O
(1)步骤I中发生反应的离子方程式: 、 。
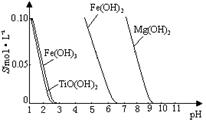 (2)已知:TiO2+易水解,只能存在于强酸性溶液中。
(2)已知:TiO2+易水解,只能存在于强酸性溶液中。
25 ℃时,难溶电解质溶解度与pH关系如右图,
TiO(OH)2溶度积Ksp=1×10-29
①步骤Ⅲ加入铁屑原因是 。
② TiO2+水解的离子方程式为 。
向溶液II中加入Na2CO3粉末的作用是 。
当溶液pH= 时,TiO(OH)2已沉淀完全。
 (3)TiCl4→Ti反应后得到Mg、MgCl2、Ti的混合物,可采用真空蒸馏的方法分离得到Ti,依据下表信息,需加热的温度略高于 ℃即可。
(3)TiCl4→Ti反应后得到Mg、MgCl2、Ti的混合物,可采用真空蒸馏的方法分离得到Ti,依据下表信息,需加热的温度略高于 ℃即可。
| TiCl4 | Mg | MgCl2 | Ti | |
| 熔点/℃ | -25.0 | 648.8 | 714 | 1667 |
| 沸点/℃ | 136.4 | 1090 | 1412 | 3287 |
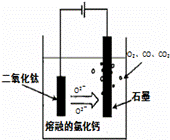
(4)电解TiO2制备钛的方法如右图所示。该方法由于具备生产过程简化、生产成本低、产品质量高、环境友好等诸多优点而引人注目。已知TiO2熔融状态下不发生电离,电解时阴极反应式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
为了使宇航员在飞船中得到一个稳定的、良好的生存环境,一般在飞船内安装盛有Na2O2或K2O2颗粒的装置,它的用途是产生氧气。下列关于Na2O2的叙述正确的是
①Na2O2中阴、阳离子的个数比是1:1
②Na2O2分别与水及CO2反应产生等量氧气时,需水和CO2的质量相等
③Na2O2分别与水及CO2反应产等量氧气时,转移电子的物质的量相等
④Na2O2的漂白原理与SO2的漂白原理相同
⑤Na2O2与SO2反应生成Na2SO3与H2O
⑥Na2O2能与酸反应生成盐和水,所以Na2O2是碱性氧化物
⑦Na2O2与水反应,Na2O2既是氧化剂,又是还原剂
⑧Na2O2投入到紫色石蕊试液中,溶液先变蓝,后褪色
A.①③⑥⑧ B.③⑦⑧ C②⑤⑥⑦ D.①④⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
铜及其化合物在生产生活中有着广泛的应用,铜在化合物中的常见化合价有+1、+2。
(1)工业上可用Cu2S+O2 2Cu+SO2反应制取粗铜,反应中被氧化的元素是_____,当消耗32 g Cu2S时,转移电子数目是____________。
2Cu+SO2反应制取粗铜,反应中被氧化的元素是_____,当消耗32 g Cu2S时,转移电子数目是____________。
(2)将少量铜丝放人适量的稀硫酸中,温度控制在50℃-60℃,加入H2O,反应一段时间后可制得硫酸铜,发生反应的离子方程式为:__________________________________。CuSO4溶液中加入一定量的Na2SO3溶液和NaCl溶液加热,生成CuCl沉淀,写出生成CuCl的离子方程式___________________________。
(3)某小组同学在做铜与浓硫酸反应的实验时,发现铜片表面有黑色固体生成。
①甲同学猜想:黑色固体是未来得及溶解于酸的CuO,其猜想可用化学方程式表示为:
Cu+H2SO4 ________________________________________________。
________________________________________________。
②乙同学认为:黑色固体除CuO外,还可能含有Cu2S和CuS,其理由可能是____(填字母)。
a. Cu2S和CuS都是黑色的
b.铜与浓硫酸在加热条件下反应,还可能放出O2
c.浓硫酸是氧化剂,铜是还原剂,Cu的化合价升高与S的化合价降低有多种可能
查看答案和解析>>
科目:高中化学 来源: 题型:
从海带中制取单质碘需要经过灼烧、溶解、过滤、氧化、萃取、分液、蒸馏等操作。下列图示 对应的装置合理、操作规范的是
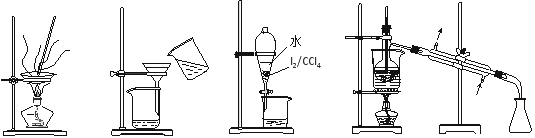
A.灼烧 B.过滤 C.分液 D.蒸馏
查看答案和解析>>
科目:高中化学 来源: 题型:
2SO2(g)+O2(g)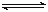 2SO3(g)是工业制硫酸的主要反应之一。一定温度下,在甲、乙、丙、丁四个容器体积均为2 L的恒容密闭容器中投料,其起始物质的量及含硫反应物的平衡转化率如下表所示:
2SO3(g)是工业制硫酸的主要反应之一。一定温度下,在甲、乙、丙、丁四个容器体积均为2 L的恒容密闭容器中投料,其起始物质的量及含硫反应物的平衡转化率如下表所示:
| 甲 | 乙 | 丙 | 丁 | ||
| 起始物质的量 | n(SO2)/mol | 0.40 | 0 | 0.80 | 0.02 |
| n(O2)/mol | 0.24 | 0 | 0.48 | 0.04 | |
| n(SO3)/mol | 0 | 0.40 | 0 | 0.40 | |
| 含硫反应物的平衡转化率% | 80 |
|
|
|
下列判断中,正确的是
A.乙中SO3的平衡转化率为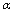 1=20% B.平衡时,丙中c(SO3)是甲中的2倍
1=20% B.平衡时,丙中c(SO3)是甲中的2倍
C.平衡时,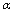 3<
3<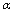 1 D.该温度下,平衡常数的值为400
1 D.该温度下,平衡常数的值为400
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是
A.向Na2CO3饱和溶液中通入过量CO2,有NaHCO3结晶析出
B.向FeSO4溶液中通入过量CO2,有浑浊现象产生
C.SO2具有漂白性,常用于自来水消毒
D.Fe和Br2混合加热生成FeBr2
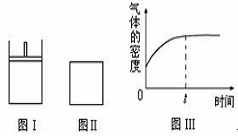
查看答案和解析>>
科目:高中化学 来源: 题型:
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
①CH3OH(g)+H2O(g)═CO2(g)+3H2(g)△H=+49.0kJ/mol
②CH3OH(g)+O2(g)═CO2(g)+2H2(g)△H=﹣192.9kJ/mol
根据上述反应,下列说法正确的是( )
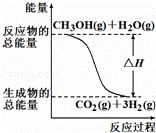
|
| A. | 反应①中的能量变化如图所示 |
|
| B. | CH3OH转变成H2的过程一定要吸收能量 |
|
| C. | 1mol CH3OH充分燃烧放出的热量为192.9kJ |
|
| D. | 可推知2H2(g)+O2(g)═2H2O(g)△H=﹣483.8 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关实验的叙述正确的是 ( )
A.可用碱式滴定管量取12.85 mL KMnO4溶液
B.实验室蒸馏石油可用如图甲所示实验装置
C.取用金属钠或钾时,没用完的钠或钾要放回原瓶
D.配制500 mL 0.4 mol·L-1 NaCl溶液,必要的仪器如图乙所示
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com