
二氧化硫和氮氧化物(NOx)对大气污染日趋严重,研究消除大气污染的方法是化学工作者的重要课题,目前有很多种方法消除大气污染。
(1)可利用甲烷催化还原NOx的方法处理NOx ,反应如下:
CH4(g)+4NO2(g) = 4NO(g)+CO2(g)+2H2O(g);△H= -574 kJ·mol-1
CH4(g)+4NO(g) = 2N2(g)+CO2(g)+2H2O(g);△H= -1160 kJ·mol-1
则CH4(g)+2NO2(g) = N2(g)+CO2(g)+2H2O(g);△H= ;
(2)降低汽车尾气的方法之一是在排气管上安装催化转化器,发生如下反应:2NO(g)+2CO(g) N2(g)+2CO2(g);△H<0。
N2(g)+2CO2(g);△H<0。
若在一定温度下,将2molNO、1molCO充入1L固定容积的容器中,15分钟后达到平衡,反应过程中各物质的浓度变化如图甲所示,则平衡常数K= (小数点后保留3位);
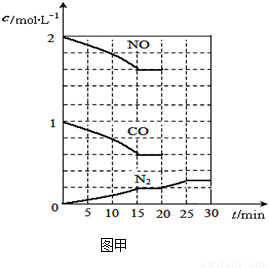
①若保持温度不变,20min时再向容器中充入CO气体0.6mol,平衡将 移动(填“向左”、“向右”或“不”);
②若保持温度不变,20min时向原平衡容器中充入CO、N2各0.6mol,平衡将 移动(填“向左”、“向右”或“不”);
③20min时,若改变反应条件,导致N2浓度发生如图所示的变化,则改变的条件可能是
(填字母);
A.加入催化剂 B.降低温度 C.缩小容器体积 D.增加CO2的量
(3)利用Fe2+、Fe3+的催化作用,常温下将SO2转化为SO42-,从 而实现对SO2的处理(总反应为2SO2+O2+2H2O=2H2SO4)。已知,含SO2的废气通入含Fe2+、Fe3+的溶液时,其中一个反应的离子方程式为4Fe2+ + O2+ 4H+ =4Fe3+ + 2H2O,则另一反应的离子方程式为 ;
(1)△H=-867 kJ·mol–1 (3分)
(2)K=0.035(或带单位:L/mol)(3分);向右、不移动; B(各2分)
(3)2Fe3++SO2+2H2O=2Fe2++SO42-+4H+(3分)
【解析】
试题分析:(1) ①CH4(g) + 4NO2(g) = 4NO(g) + CO2(g) + 2H2O(g) △H= –574 kJ·mol–1;
②CH4(g) + 4NO(g) = 2N2(g) + CO2(g) + 2H2O(g) △H= – 1160 kJ·mol–1;
依据盖斯定律计算①+ ②得到:CH4(g) + 2NO2(g) = N2(g) + CO2(g) + 2H2O(g) △H= –867 kJ·mol–1;
故答案为:△H= –867 kJ·mol–1;
(2)依据图象分析,15min时达到平衡时N2浓度为0.2mol·L–1,NO平衡浓度为1.6mol·L–1,CO浓度为0.6 mol·L–1,CO2浓度为0.4 mol·L–1,反应2NO(g) + 2CO(g) 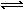 N2(g) + 2CO2(g)的平衡常数
N2(g) + 2CO2(g)的平衡常数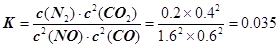 。故答案为:0.035。①若保持温度不变,20min时再向容器中充入CO气体0.6mol,此时c(CO) = 1.2 mol·L–1,而生成物浓度不变,根据平衡移动原理,平衡将正反应方向移动。②若保持温度不变,20min时再向容器中充入CO、N2各0.6mol,浓度分别为c(NO)=1.6
mol·L–1,c(CO)=0.6 mol·L–1 + 0.6 mol·L–1 = 1.2 mol·L–1,c(N2)
= 0.2 mol·L–1 + 0.6 mol·L–1 = 0.8 mol·L–1,c(CO2)
= 0.4 mol·L–1;
。故答案为:0.035。①若保持温度不变,20min时再向容器中充入CO气体0.6mol,此时c(CO) = 1.2 mol·L–1,而生成物浓度不变,根据平衡移动原理,平衡将正反应方向移动。②若保持温度不变,20min时再向容器中充入CO、N2各0.6mol,浓度分别为c(NO)=1.6
mol·L–1,c(CO)=0.6 mol·L–1 + 0.6 mol·L–1 = 1.2 mol·L–1,c(N2)
= 0.2 mol·L–1 + 0.6 mol·L–1 = 0.8 mol·L–1,c(CO2)
= 0.4 mol·L–1;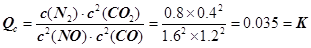 ,平衡不动。③如图甲所示,20min时,改变反应条件,导致反应速率减小,氮气浓度增大,平衡正向移动。加入催化剂,平衡不移动,A不合题;反应是气体体积减小的放热反应,降温可使平衡正向移动,氮气浓度增大,B符合题意;缩小容器体积虽然可使平衡正向移动,但改变条件的瞬间,N2浓度增大,与图中描绘的情况不符,C不合题意;增加CO2的量,平衡逆向移动,N2浓度减小,D也不合题。故答案为:B。
,平衡不动。③如图甲所示,20min时,改变反应条件,导致反应速率减小,氮气浓度增大,平衡正向移动。加入催化剂,平衡不移动,A不合题;反应是气体体积减小的放热反应,降温可使平衡正向移动,氮气浓度增大,B符合题意;缩小容器体积虽然可使平衡正向移动,但改变条件的瞬间,N2浓度增大,与图中描绘的情况不符,C不合题意;增加CO2的量,平衡逆向移动,N2浓度减小,D也不合题。故答案为:B。
(3) 总反应的离子方程式为:2SO2+O2+2H2O=4H+ + 2SO42-,总反应减去反应4Fe2+ + O2+ 4H+ =4Fe3+ + 2H2O即得另一离子方程式:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+。
考点:本题考查热化学方程式和盖斯定律的计算应用,化学平衡影响因素分析,平衡常数的计算方法,平衡移动原理的应用,离子方程式的书写。


科目:高中化学 来源: 题型:阅读理解
 二氧化硫和氮氧化物是常用的化工原料,也会给大气带来严重污染,综合治理其污染是环境化学当前的重要研究内容之一.
二氧化硫和氮氧化物是常用的化工原料,也会给大气带来严重污染,综合治理其污染是环境化学当前的重要研究内容之一.| 3(2a+b) |
| 80 |
| 3(2a+b) |
| 80 |
| 催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| V(臭氧空气) | V(烟气) |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

查看答案和解析>>
科目:高中化学 来源: 题型:
二氧化硫和氮氧化物是常用的化工原料,也会给大气带来严重污染,综合治理其污染是环境化学当前的重要研究内容之一。
(1) 新型氨法烟气脱硫技术的化学原理是采用氨水吸收烟气中的SO2,其吸收的化学反应方程式为 再用一定量的磷酸与上述吸收产物反应。该技术的优点除了能回收利用SO2外,还能得到一种复合肥料,该复合肥料可能的化学式为 (只要求写一种)。
(2) 工业上生产硫酸时,将SO2氧化为SO3是关键一步。
① 某温度下,SO2(g)+1/2O2(g)![]() SO3(g);△H= —98 kJ· mol—1。开始时在10L的密闭容器中加入4.0mol SO2(g)和5.0molO2(g),当反应达到平衡时混合气体的总物质的量为8.0mol,该温度下平衡常数K= 。
SO3(g);△H= —98 kJ· mol—1。开始时在10L的密闭容器中加入4.0mol SO2(g)和5.0molO2(g),当反应达到平衡时混合气体的总物质的量为8.0mol,该温度下平衡常数K= 。
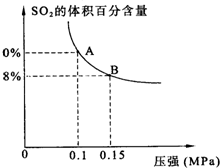
② 一定条件下,向一带活塞的密闭容器中充入2molSO2和1molO2,发生下列反应:2SO2(g)+O2(g)![]() 2SO3(g)达到平衡后改变下述条件,SO3的体积分数变大的是
2SO3(g)达到平衡后改变下述条件,SO3的体积分数变大的是
A、保持温度和容器压强不变,充入2mol SO3
B、保持温度和容器体积不变,充入2mol N2
C、保持温度和容器体积不变,充入0.5mol SO2和0.25mol O2
D、升高温度
E、移动活塞压缩气体
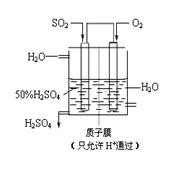
(3) 某人设想以如图所示装置用电化学原理生产硫酸,通入O2的一极的电极为 极; 写出通入SO2的电极的电极反应式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
(13分)二氧化硫和氮氧化物是常用的化工原料,也会给大气带来严重污染,综合治理其污染是环境化学当前的重要研究内容之一。
(1)汽车尾气中主要含有CO、NO2、SO2、CO2气体,其中 能导致光化学烟雾的形成;
目前采用的是在汽车排气装置中安装一个净化器,可以有效的将尾气中的有害气体转化。如:CO(g)+NO2(g) NO(g)+CO2(g) △H=-akJ·mol—1(a>0)2CO(g)+2NO2(g) N2(g)+2CO2(g) △H=-bkJ·mol—1(b>0)
据此回答:若用标准状况下3.36升CO还原NO2至N2(CO完全反应)的整个过程中转移电子的物质的量为 mol,放出的热量为 kJ(用含有a和b的代数式表示)。
⑵新型氨法烟气脱硫技术的化学原理是采用氨水吸收烟气中的SO2,再用一定量的磷酸与上述吸收产物反应。该技术的优点除了能回收利用SO2外,还能得到一种复合肥料,该复合肥料可能的化学式为 (只要求写一种)。
(3)工业上生产硫酸时,将SO2氧化为SO3是关键一步。
①某温度下,SO2(g)+1/2O2(g)![]() SO3(g);△H= —98 kJ· mol—1。开始时在10L的密闭容器中加入4.0mol SO2(g)和5.0molO2(g),当反应达到平衡时共放出热量196kJ,该温度下平衡常数K= 。
SO3(g);△H= —98 kJ· mol—1。开始时在10L的密闭容器中加入4.0mol SO2(g)和5.0molO2(g),当反应达到平衡时共放出热量196kJ,该温度下平衡常数K= 。
②一定条件下,向一带活塞的密闭容器中充入2molSO2和1molO2,发生下列反应:2SO2(g)+O2(g)![]() 2SO3(g)达到平衡后改变下述条件SO3 的体积分数变大的是
2SO3(g)达到平衡后改变下述条件SO3 的体积分数变大的是
A.保持温度和容器压强不变,充入2mol SO3
B.保持温度和容器体积不变,充入2mol N2
C.保持温度和容器体积不变,充入0.5mol SO2和0.25mol O2
E.升高温度 F.移动活塞压缩气体
(4)某人设想以右上图所示装置用电化学原理生产硫酸,写出通入SO2的电极的电极反应式:
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com