
| A. | 平衡时,v正(O2)=v逆(O2)=0必成立 | |
| B. | 关系式5v正(O2)=4v正(NO)总成立 | |
| C. | 在同一段时间范围内,用上述四种物质NH3、O2、NO、H2O的变化表示正反应速率的数值中,v正(H2O)最大 | |
| D. | 若投入4 mol NH3和5 mol O2,通过控制外界条件,必能生成4 mol NO |
分析 A.可逆反应属于动态平衡,平衡时正、逆反应速率相等但不为0;
B.速率之比等于化学计量数之比;
C.速率之比等于化学计量数之比;
D.可逆反应中反应物不能全部转化为生成物.
解答 解:A.可逆反应属于动态平衡,平衡时同种物质的生成速率与消耗速率相等但不为0,故A错误;
B.速率之比等于化学计量数之比,则4v正(O2)=5v正(NO),故B错误;
C.在同一段时间范围内,用上述四种物质NH3、O2、NO、H2O的变化表示正反应速率的数值中,由于H2O的计量数最大,所以v正(H2O)最大,故C正确;
D.可逆反应中反应物不能全部转化为生成物,则投入4 mol NH3和5 mol O2,不论怎样控制外界条件,生成NO的物质的量一定小于4 mol,故D错误,
故选:C.
点评 本题考查化学平衡状态特征、可逆反应的特点、反应速率与计量数的关系等,题目难度不大,注意把握同一反应中速率之比等于化学计量数之比.


科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
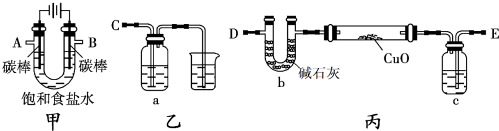
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 硫酸工业的生产工艺流程可简略表示如下:
硫酸工业的生产工艺流程可简略表示如下: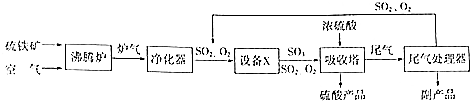 请回答下列问题:
请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用合适的催化剂可以加大反应速率 | |
| B. | 升高温度可以增大反应速率 | |
| C. | 无论如何增大H2浓度,都不能使N2转化率达到100% | |
| D. | 缩小体积,υ正增大,υ逆减小,平衡正向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
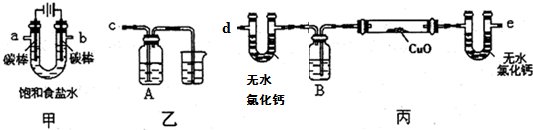
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com