
|
容积为1 L的干燥容器中充入HCl气体后,测得容器内气体对氧气的相对密度为1.082.用此气体进行喷泉实验,当喷泉停止后,进入容器中液体的体积是( ). | |
A. |
0.25 L |
B. |
0.5 L |
C. |
0.75 L |
D. |
1 L |
 快捷英语周周练系列答案
快捷英语周周练系列答案科目:高中化学 来源: 题型:
 Ⅰ.如图所示为常见仪器的部分结构.
Ⅰ.如图所示为常见仪器的部分结构.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 起始浓度(mol. L-1) | c( NH3) | c( O2) | c( NO) | c( H20) |
| 甲 | 1 | 2 | 0 | 0 |
| 乙 | 2 | 4 | 0 | 0 |
| 丙 | 0.5 | x | y | z |
查看答案和解析>>
科目:高中化学 来源:2011-2012学年山西省高三10月份月考化学试卷 题型:实验题
(10分)为维持人体血液中的血糖含量,在给病人输液时,通常用葡萄糖注射液,下图是医院给病人输液时使用的一瓶质量分数为5%的葡萄糖(C6H12O6)注射液的标签。某学生欲在实验室中配制500 mL该葡萄糖注射液。
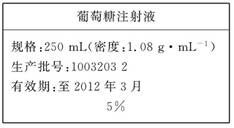
实验用品:葡萄糖晶体(摩尔质量:180 g/mol)、蒸馏水、烧杯、容量瓶(500 mL)、药匙、胶头滴管、量筒。
(1)还缺少的仪器有_ 。
(2)下列对容量瓶及其使用方法的描述中正确的是_ _。
A.使用前要检查容量瓶是否漏水
B.容量瓶用蒸馏水洗净后,再用标准葡萄糖注射液润洗
C.配制溶液时,把称好的葡萄糖晶体小心倒入容量瓶中,加入蒸馏水到接近刻度线1~2 cm处,改用胶头滴管加蒸馏水至刻度线
D.容量瓶上标有容积、温度和浓度
(3)实验中需取用晶体的质量为__ __,物质的量浓度_ _。
(4)配制0.1 mol/L的NaCl溶液,下列操作会导致所配溶液的物质的量浓度偏高的是__ 。
A.没有将洗涤液转移到容量瓶 B.定容时俯视读取刻度
C.原容量瓶洗净后未干燥 D.定容时液面超过了刻度线
查看答案和解析>>
科目:高中化学 来源:2011-2012年湖北省高一上学期期中考试化学试卷 题型:实验题
(18分)Ⅰ.如图所示为常见仪器的部分结构。
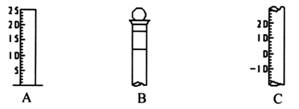
(1)请写出下列仪器的名称:A ,B ,C 。
(2)仪器B上标记有 (填序号)。
①质量 ②温度 ③刻度线 ④浓度 ⑤容积
(3)仪器B使用前必须 。
Ⅱ.现用98%的浓H2SO4(密度为1.84g/cm3)来配制480mL0.2mol/L的稀H2SO4。
有关操作为:①计算所需浓硫酸的体积 ②量取一定体积的浓硫酸 ③稀释、冷却 ④转移、洗涤 ⑤定容 ⑥摇匀
回答下列问题
(4)应量取的浓硫酸体积是 ,实验中所用的玻璃仪器除烧杯、玻璃棒、
量筒、胶头滴管外还有 ;
(5)第③步中稀释浓硫酸的操作是
(6)将所配制的稀H2SO4进行测定,发现实际浓度大于0.2mol/L。请你分析下列哪些操作会引起所配浓度偏大(填写字母) 。
A.用量筒量取浓硫酸时,仰视量筒的刻度
B.容量瓶未干燥即用来配制溶液
C.浓硫酸在烧杯中稀释后,未冷却就立即转移到容量瓶中,并进行定容
D.往容量瓶转移时,有少量液体溅出
E.烧杯未进行洗涤
F.在容量瓶中定容时俯视容量瓶刻度线
G.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com