
| A.反应过程中得到6.72 L的气体(标况) |
| B.最终得到的溶液中c(Na+)=c(Cl-)+c(OH-) |
| C.最终得到7.8 g的沉淀 |
| D.最终得到的溶液中c(NaCl)=0. 15 mol/L |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:单选题
 ?pC(g)+qD(g)(如右图)表示的是转化率与压强、温度的关系。分析图中曲线可以得出的结论是( )
?pC(g)+qD(g)(如右图)表示的是转化率与压强、温度的关系。分析图中曲线可以得出的结论是( )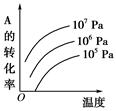
| A.正反应吸热:m+n>p+q | B.正反应吸热:m+n<p+q |
| C.正反应放热:m+n>p+q | D.正反应放热:m+n<p+q |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
 2Z + W;正反应为放热反应,(四物质均为气体)。达到平衡时。VA="1.2a" L,试回答: (A在的活塞可移动)
2Z + W;正反应为放热反应,(四物质均为气体)。达到平衡时。VA="1.2a" L,试回答: (A在的活塞可移动) 
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 □Si3N4+□CO
□Si3N4+□CO查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2B(g)+xC(g)。达平衡后,测得容器内的压强增大了p%,A的平衡转化率为a%,则下列推断中正确的是
2B(g)+xC(g)。达平衡后,测得容器内的压强增大了p%,A的平衡转化率为a%,则下列推断中正确的是| A.若x=2,则p>0.5a | B.若x=3,则p<0.7a |
| C.若x=4,则p= a | D.若x= 5,则p≥a |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 C(g)+D(g),5min后达平衡,各物质的平衡浓度的关系为[c(A)]a·c(B)= c(C)·c(D)。若在温度不变的情况下将容器的体积扩大为原来的10倍,A的转化率不发生变化,则B的转化率为
C(g)+D(g),5min后达平衡,各物质的平衡浓度的关系为[c(A)]a·c(B)= c(C)·c(D)。若在温度不变的情况下将容器的体积扩大为原来的10倍,A的转化率不发生变化,则B的转化率为查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 温度/℃ | 25 | t1 | t2 |
| 水的离子积常数 | 1×10-14 | a | 1×10-12 |
 5Ca2+(aq)+3PO(aq)+OH-(aq);Ksp=2.5×10-59。进食后,细菌和酶作用于食物,产生有机酸,这时牙齿就会受到腐蚀,其原因是 。
5Ca2+(aq)+3PO(aq)+OH-(aq);Ksp=2.5×10-59。进食后,细菌和酶作用于食物,产生有机酸,这时牙齿就会受到腐蚀,其原因是 。 N2O4(g)的平衡常数K= 。若NO2起始浓度为2 mol/L ,相同条件下,NO2的最大转化率为 。
N2O4(g)的平衡常数K= 。若NO2起始浓度为2 mol/L ,相同条件下,NO2的最大转化率为 。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2SO3(g),达到平衡时, 18O存在于( )
2SO3(g),达到平衡时, 18O存在于( )| A.只存在于O 2中 |
| B.只存在于O 2和SO3中 |
| C.只存在于SO2和SO3中 |
| D.SO3、SO2和O 2中都有可能存在 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
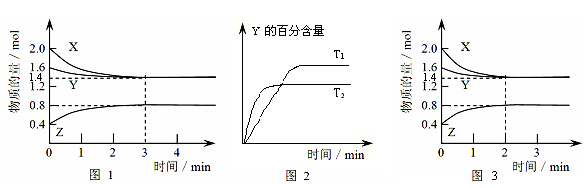
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com