
 +Cl2$\stackrel{光照}{→}$
+Cl2$\stackrel{光照}{→}$ .B和D反应生成F的化学方程式
.B和D反应生成F的化学方程式 .D→E的化学方程式2
.D→E的化学方程式2 +O2$→_{△}^{Cu}$2
+O2$→_{△}^{Cu}$2 +2H2O.
+2H2O. .
. CH2OCH2CH2CHO B.
CH2OCH2CH2CHO B. CH=CHCH2CH2CHO
CH=CHCH2CH2CHO COOCH2CH2CH3 D.CH2=CHCH=CHCH=CHCH=CHCOOH.
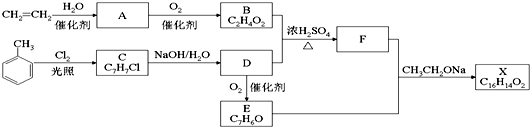
COOCH2CH2CH3 D.CH2=CHCH=CHCH=CHCH=CHCOOH. 分析 乙烯与水在催化剂作用下发生加成反应生成乙醇,故A是CH3CH2OH,乙醇催化氧化最终生成乙酸,故B是CH3COOH;甲苯在光照条件下与氯气发生的是取代反应,则C为 ,C在氢氧化钠的水溶液中发生的是取代反应,那么D应为
,C在氢氧化钠的水溶液中发生的是取代反应,那么D应为 ,由D能被氧化为E,且结合给出的信息:RCHO+CH3COOR′$\stackrel{CH_{3}CH_{2}ONa}{→}$RCH=CHCOOR′,那么应E为
,由D能被氧化为E,且结合给出的信息:RCHO+CH3COOR′$\stackrel{CH_{3}CH_{2}ONa}{→}$RCH=CHCOOR′,那么应E为 ,据此推断得出F为:
,据此推断得出F为: ,那么X为
,那么X为 ,据此分析解答.
,据此分析解答.
解答 解:乙烯与水在催化剂作用下发生加成反应生成乙醇,故A是CH3CH2OH,乙醇催化氧化最终生成乙酸,故B是CH3COOH;甲苯在光照条件下与氯气发生的是取代反应,则C为 ,C在氢氧化钠的水溶液中发生的是取代反应,那么D应为
,C在氢氧化钠的水溶液中发生的是取代反应,那么D应为 ,由D能被氧化为E,且结合给出的信息:RCHO+CH3COOR′$\stackrel{CH_{3}CH_{2}ONa}{→}$RCH=CHCOOR′,那么应E为
,由D能被氧化为E,且结合给出的信息:RCHO+CH3COOR′$\stackrel{CH_{3}CH_{2}ONa}{→}$RCH=CHCOOR′,那么应E为 ,据此推断得出F为:
,据此推断得出F为: ,那么X为
,那么X为 ,
,
(1)通过以上分析知,生成A的反应类型加成反应,D的分子式 C7H8O,B为CH3COOH,B中官能团的名称是羧基,故答案为:加成反应; C7H8O;羧基;
(2)生成C的化学方程式为 +Cl2$\stackrel{光照}{→}$
+Cl2$\stackrel{光照}{→}$ ,B为乙酸,D为苯甲醇,两者发生酯化反应生成乙酸苯甲酯,化学反应方程式为:
,B为乙酸,D为苯甲醇,两者发生酯化反应生成乙酸苯甲酯,化学反应方程式为: ,
,
D为苯甲醇,D发生氧化反应得E,化学反应方程式为:2 +O2$→_{△}^{Cu}$2
+O2$→_{△}^{Cu}$2 +2H2O,
+2H2O,
故答案为: +Cl2$\stackrel{光照}{→}$
+Cl2$\stackrel{光照}{→}$ ;
; ;
;
2 +O2$→_{△}^{Cu}$2
+O2$→_{△}^{Cu}$2 +2H2O
+2H2O
(3)X的结构简式 ,故答案为:
,故答案为: ;
;
(4)X为 ,
,
A.不含醛基,所以不能与新制的Cu(OH)2悬浊液能发生反应,故错误;
B.含有苯环,与浓硝酸能发生取代反应,故正确;
C.含有碳碳双键,且连接苯环的碳原子上含有H原子,所以能使酸性KMnO4溶液褪色,故正确;
D.含有酯基,所以能发生水解反应,故错误;
故选BC;
(5)分子式为:C9H10O2,AC中都含有10个碳原子,BD中分子式与F相同且结构不同,所以属于同分异构体,故选BD.
点评 本题主要考查的是有机物的合成与有机物的推断,充分掌握常见有机化合物的性质以及抓住所给信息解题是关键,难点是同分异构体判断,注意连接苯环的碳原子上含有氢原子的苯的同系物也能被酸性高锰酸钾溶液氧化,题目难度不大.


科目:高中化学 来源: 题型:解答题
 乙苯催化脱氢制苯乙烯反应:
乙苯催化脱氢制苯乙烯反应: CH2CH3(g)$\stackrel{催化剂}{?}$
CH2CH3(g)$\stackrel{催化剂}{?}$ CH2═CH2(g)+H2(g)
CH2═CH2(g)+H2(g)| 化学键 | C-H | C-C | C=C | H-H |
| 键能/kJ•molˉ1 | 412 | 348 | 612 | 436 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg2+、Fe3+、NO3-、SCN- | B. | Al3+、Fe2+、Cl-、SO42- | ||
| C. | K+、Na+、Cl-、HCO3- | D. | Na+、CH3COO-、NO3-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室常用地康法制氯气 | B. | 氧化性强弱顺序是O2>KMnO4>MnO2 | ||
| C. | 氧化性强弱顺序是KMnO4>O2>MnO2 | D. | 氧化性强弱顺序是KMnO4>MnO2>O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀硝酸和过量的铁屑反应:Fe+4H++NO3-═Fe3++NO↑+2H2O | |
| B. | NH4HCO3溶液与足量的NaOH溶液混合加热:NH4++HCO3-+2OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3?↑+CO32-+2H2O | |
| C. | 碳酸氢钠溶液水解的离子方程式:HCO3-+H2O?CO32-+H3O+ | |
| D. | Fe(OH)3溶于氢碘酸中:Fe(OH)3+3H+═Fe3++3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2燃烧热为285.8 kJ•mol-1,则2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ•mol-1 | |
| B. | 若C(石墨,s)=C(金刚石,s)△H>0,则石墨比金刚石稳定 | |
| C. | 已知NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=-57.4 kJ•mol-1,则0.5mol NaOH固体与稀盐酸完全中和,放出28.7kJ的热量 | |
| D. | 已知2SO2(g)+O2(g)?2SO2 (g)△H=-196.64 kJ•mol-1,在一定温度下,向一固定体积的密闭容器中通入2mol SO2、1mol O2,达到平衡时放出热量小于196.64 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.3gNa投入到97.7g水中形成的溶液溶质质量分数为4% | |
| B. | 25gCuSO4•5H2O溶于75g水之后,溶质的质量分数为16% | |
| C. | 相同质量的Na2O和Na2O2溶于相同体积的足量水中,所得溶液的质量分数相同 | |
| D. | 向含Na2CO310.6g的饱和碳酸钠溶液中通入过量CO2,所得溶液溶质质量为16.8g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化剂的作用 | B. | 还原剂的作用 | C. | 催化剂的作用 | D. | 吸附剂的作用 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com