
| A. | 硅胶可用作食品的抗氧化剂 | |
| B. | 可用热碱水清洗炊具上的油渍 | |
| C. | 铁表面镀锌可增强其抗腐蚀性 | |
| D. | 大量燃烧化石燃料是导致雾霾天气的重要因素之一 |
分析 A.硅胶不具有还原性;
B.加热条件下有利于盐类、油脂的水解;
C.铁表面镀锌,可起到防护作用;
D.大量燃烧化石燃料,可导致雾霾.
解答 解:A.硅胶具有吸附性,可用作干燥剂等,不具有还原性,故A错误;
B.加热条件下有利于盐类、油脂的水解,可用热碱水清洗炊具上的油渍,故B正确;
C.铁表面镀锌,可起到防护作用,如表面破损,锌比铁活泼,锌为负极,也能起到防护作用,故C正确;
D.大量燃烧化石燃料,产生大量的粉尘等,可导致雾霾,故D正确.
故选A.
点评 本题考查较为综合,涉及二氧化硅、油脂的水解、金属的腐蚀以及环境保护等知识,为高考常见题型,侧重于化学与生活、生产的考查,有利于培养学生良好的科学素养,提高学生学习的积极性,难度不大.


 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案科目:高中化学 来源: 题型:解答题
 乙苯(
乙苯(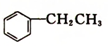 )在有机合成中占有重要的地位,有着广泛的用途.
)在有机合成中占有重要的地位,有着广泛的用途.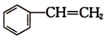 (g)+HCl(g)?
(g)+HCl(g)? (g)△H1=-54kJ•mol-1
(g)△H1=-54kJ•mol-1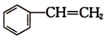 (g)+H2(g)?
(g)+H2(g)? (g)△H2=-121kJ•mol-1
(g)△H2=-121kJ•mol-1| 化学键 | C-H | C-C | C=C | C-Cl | H-Cl |
| 键能/(kJ•mol-1) | 412 | 348 | X | 341 | 432 |
 (g)+Cl2(g)?
(g)+Cl2(g)? (g)+HCl(g)△H4
(g)+HCl(g)△H4 (g)、2mol Cl2(g)、1mol
(g)、2mol Cl2(g)、1mol  (g)、2mol HCl(g),则开始时,v正=(填“>”、“<”或“=”)v逆.
(g)、2mol HCl(g),则开始时,v正=(填“>”、“<”或“=”)v逆.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在光分解催化剂存在下,利用太阳能分解水制H2 | |
| B. | 以焦炭和水为原料制水煤气后再分离出H2 | |
| C. | 以金属钠与水反应生成H2 | |
| D. | 由热电站提供电力电解水产生H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氨和肼(N2H4)是氮的两种常见化合物,在科学技术和生产中有广泛应用.回答下列问题:
氨和肼(N2H4)是氮的两种常见化合物,在科学技术和生产中有广泛应用.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
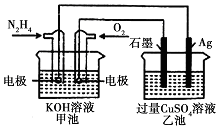
| A. | 该装置工作时,Ag电极上有气体生成 | |
| B. | 甲池和乙池中的溶液的pH均减小 | |
| C. | 甲池中负极反应为N2H4-4e-═N2+4H+ | |
| D. | 当甲池中消耗0.1molN2H4时,乙池中理沦上最多产生6.4g固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=2的H2SO4与pH=12的NaOH等体积混合,所得溶液呈酸性 | |
| B. | 0.1mol/L的CH3COOH溶液在加水稀释过程中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)•c(O{H}^{-})}$减小 | |
| C. | pH=5的NaHSO4溶液中水的电离程度小于纯水的电离程度 | |
| D. | 0.1mol/L的NaHCO3溶液中:c(OH-)═(H+)+2c(H2CO3)+c(HCO3-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Mn(OH)2 |
| Ksp | 8.0×10-16 | 4.0×l0-38 | 4.5×10-33 | 1.9×l0-13 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 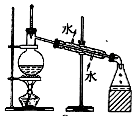 装置常用于分离互不相溶的液体混合物 | |
| B. | 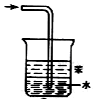 装置可用于吸收氨气,且能防止倒吸 | |
| C. | 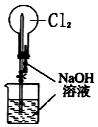 用装置不可以完成“喷泉”实验 | |
| D. | 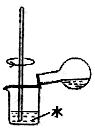 用装置稀释浓硫酸和铜反应冷却后的混合液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com