
【题目】将6.2 g有机物A与足量O2在密闭容器中充分燃烧,产物只有H2O和CO2,产物通过浓H2SO4后,质量增加5.4g,再通过碱石灰完全吸收,质量增加8.8g。用质谱法测得A的分子量为62;
(1)写出其分子式_____________________;
(2)若0.2mol的该有机物恰好与9.2g的金属钠完全反应,计算并推断出该有机物的结构简式____________。
(3)它在核磁共振氢谱中将会出现___________个信号.
【答案】 C2H6O2 HOCH2CH2OH 2
【解析】(1)产物通过浓H2SO4后,质量增加5.4g为水,则有机物A燃烧生成水的物质的量为:![]() =0.3mol,可知6.2g有机物中含有0.6molH,碱石灰增重的8.8g为二氧化碳的质量,则有机物A完全燃烧生成CO2的物质的量为:n(CO2)=
=0.3mol,可知6.2g有机物中含有0.6molH,碱石灰增重的8.8g为二氧化碳的质量,则有机物A完全燃烧生成CO2的物质的量为:n(CO2)=![]() =0.2mol,可推知6.2gA中含有0.2molC,6.2gA中含有C、H元素的质量为:12g/mol×0.2mol+0.6mol×1g/mol=3g<6.2g,则有机物A中一定含有氧元素,6.2g有机物A中含有氧元素的物质的量为:
=0.2mol,可推知6.2gA中含有0.2molC,6.2gA中含有C、H元素的质量为:12g/mol×0.2mol+0.6mol×1g/mol=3g<6.2g,则有机物A中一定含有氧元素,6.2g有机物A中含有氧元素的物质的量为:![]() =0.02mol,则:n(C):n(H):n(O)=0.2molH:0.6molH:0.2molH=1:3:1,所以有机物A的实验式为:CH3O;用质谱法测得A的分子量为62,设A的分子式为:(CH3O)n,n=
=0.02mol,则:n(C):n(H):n(O)=0.2molH:0.6molH:0.2molH=1:3:1,所以有机物A的实验式为:CH3O;用质谱法测得A的分子量为62,设A的分子式为:(CH3O)n,n=![]() =2,则有机物A的分子式为:C2H6O2;(2)若0.2mol的该有机物恰好与9.2g的金属钠完全反应,9.2g钠的物质的量为:n(Na)=
=2,则有机物A的分子式为:C2H6O2;(2)若0.2mol的该有机物恰好与9.2g的金属钠完全反应,9.2g钠的物质的量为:n(Na)=![]() =0.4mol,根据关系式2-OH~H2可知,该有机物的分子中含有:
=0.4mol,根据关系式2-OH~H2可知,该有机物的分子中含有:![]() =2个羟基,其结构简式为:HOCH2CH2OH;HOCH2CH2OH中含有两种化学环境不同的H原子,则它在核磁共振氢谱中将会出现2个信号峰。
=2个羟基,其结构简式为:HOCH2CH2OH;HOCH2CH2OH中含有两种化学环境不同的H原子,则它在核磁共振氢谱中将会出现2个信号峰。


科目:高中化学 来源: 题型:
【题目】将含有C、H、O的有机物3.24 g装入元素分析装置,通入足量的O2使之完全燃烧,将生成的气体依次通过CaCl2管(A)和碱石灰(B),测得A管质量增加了2.16 g,B管增加了9.24 g,已知该有机物的相对分子质量为108。
(1)燃烧此有机物3.24 g需消耗O2多少g?
(2)求此有机物的分子式。
(3)该有机物1分子中有1个苯环,试写出它的同分异构体的结构简式。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现将13.92g的MnO2与150g 36.5%盐酸(盐酸足量)共热,向反应后的溶液加入足量的硝酸银溶液,产生白色沉淀。若不考HCl的挥发,下列说法正确的是
A. 生成AgCl沉淀为0.86mol B. 转移电子数0.64NA
C. 被氧化的HCl为0.32mol D. 产生Cl2 3.584L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取一定质量NaHCO3和Na2O的固体混合物溶于适量的水,将所得溶液分成两等份,向其中一份水溶液中缓慢逐滴加入某物质的量浓度的盐酸,产生的气体体积与所加盐酸体积之间的关系如图所示;向另一份水溶液中加入过量Ba(OH)2溶液,得到白色沉淀39.4g。试回答下列问题:

(1)盐酸的物质的量浓度为___________;
(2)固体混合物中NaHCO3与Na2O物质的量之比_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式碳酸镁和碱式碳酸铝镁均可作为塑料填料。由蛇纹石制取碱式碳酸镁的实验步骤如下:
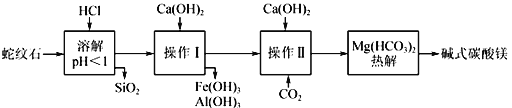
(蛇纹石矿可以看作由MgO、Fe2O3、Al2O3、SiO2组成)
(1)上述实验中,可以循环使用的物质是______(填化学式)。
(2)操作Ⅰ中的Ca(OH)2要适量,其原因是____________________________。
(3)写出操作Ⅱ中生成Mg(HCO3)2的化学方程式:____________________________________。
(4)为确定碱式碳酸铝镁[MgaAlb(OH)c(CO3)d·xH2O]的组成,进行如下实验:①准确称取5.085 g样品与足量稀盐酸充分反应,生成CO2 0.840 L(已换算成标准状况下)。②另取一定量样品在空气中加热,样品的固体残留率(固体样品的剩余质量/固体样品的起始质量×100%)随温度的变化如图所示(样品在270℃时已完全失去结晶水,600 ℃以上残留固体为金属氧化物的混合物)。
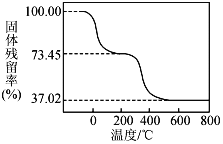
根据以上实验数据计算5.085 g碱式碳酸铝镁样品中的n(OH-)(写出计算过程)_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近几年我国大面积发生雾霾天气,2.5微米以下的细颗粒物(PM2.5)是导致雾霾天气的“罪魁祸首”。空气中的CO、SO2、氮氧化物等污染气体会通过大气化学反应生成PM2.5颗粒物。
(1) 用CaSO4代替O2与燃料CO反应,是一种高效、清洁、经济的新型燃烧技术,既可提高燃烧效率,又能得到较纯的CO2,以便于被处理。反应①为主反应,反应②和③为副反应。
ⅰ.CaSO4(s)+4CO(g)==CaS(s)+4CO2(g) ΔH1=-189.2 kJ·mol-1
ⅱ.CaSO4(s)+CO(g)==CaO(s)+CO2(g)+SO2(g) ΔH2=+210.5 kJ·mol-1
ⅲ.CO(g)==![]() C(s)+
C(s)+![]() CO2(g) ΔH3=-86.2 kJ·mol-1
CO2(g) ΔH3=-86.2 kJ·mol-1
反应2CaSO4(s)+7CO(g)==CaS(s)+CaO(s)+6CO2(g)+C(s)+SO2(g)的ΔH=_________________
(2)已知由CO生成CO2的化学方程式为CO+O2![]() CO2+O。其正反应速率为v正=K正·c(CO) ·c(O2),逆反应速率为v逆=K逆·c(CO2) ·c(O),K正、K逆为速率常数。在2500 K下,K正=1.21×105 L·s-1·mol-1,K逆=3.02×105 L·s-1·mol-1。则该温度下上述反应的平衡常数K值为________(保留小数点后一位小数)。
CO2+O。其正反应速率为v正=K正·c(CO) ·c(O2),逆反应速率为v逆=K逆·c(CO2) ·c(O),K正、K逆为速率常数。在2500 K下,K正=1.21×105 L·s-1·mol-1,K逆=3.02×105 L·s-1·mol-1。则该温度下上述反应的平衡常数K值为________(保留小数点后一位小数)。
(3)用活性炭还原法可以处理氮氧化物。某研究小组向某密闭容器中加入一定量的活性炭和NO,发生反应:C(s)+2NO(g)![]() N2(g)+CO2(g) ΔH=Q kJ·mol-1。在T1℃时,反应进行到不同时间测得各物质的浓度如下:
N2(g)+CO2(g) ΔH=Q kJ·mol-1。在T1℃时,反应进行到不同时间测得各物质的浓度如下:
时间(min) 浓度(mol·L-1) | 0 | 10 | 20 | 30 | 40 | 50 |
NO | 1.00 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
①0~10 min内,NO的平均反应速率v(NO)=___________________________________;
②30 min后只改变某一条件,反应达新平衡,根据上表数据判断改变的条件可能是____(选填字母);
a.加入一定量的活性炭 b.通入一定量的NO c.适当缩小容器的体积 d.加入合适的催化剂
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为5∶3∶3,则Q_____0 (填“>”、“=”或“<”)。
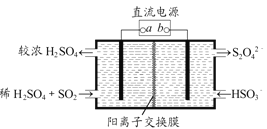
(4)利用如图所示电解装置(电极均为惰性电极)也可吸收SO2,并用阴极室排出的溶液吸收NO2。与电源b极连接的电极的电极反应式为____________________________________。
(5)NO2在一定条件下可转化为NH4NO3和NH4NO2。相同温度下,等浓度NH4NO3和NH4NO2两份溶液,测得NH4NO2溶液中c(NH4+)较小,分析可能的原因________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】周环反应是一类同时成键与断键的反应,经典的周环反应有Diels-Alder反应![]() 、电环化反应(electrocyclic reaction):
、电环化反应(electrocyclic reaction):![]() 等。
等。
已知:![]() ,其中R1、R2、R3为烷基。
,其中R1、R2、R3为烷基。
现有一种五元环状内酯I的合成路线如下(A~I均表示一种有机化合物):
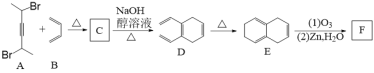
![]()
回答下列问题:
(1)化合物A中含有的官能团名称是_____________,D的分子式为________
(2)由C生成D的反应类型为_____________,A形成高聚物的结构简式为__________________
(3)由F生成G的化学方程式为____________________________________________
(4)化合物H的系统命名为_________________
(5)化合物I的质谱表明其相对分子质量为142,I的核磁共振氢谱显示为2组峰,I的结构简式为________________________
(6)在化合物I的同分异构体中能同时符合下列条件的是____________(填写结构简式)
① 具有酚结构;② 仅有一种官能团;③ 具有4种等效氢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D四种常见的金属单质,A在空气中燃烧生成淡黄色固体;B为红色固体,锈蚀时变为绿色;C在空气中加热熔化但不滴落;D在氧气中燃烧,火星四射。
根据以上信息回答下列问题:
(1)写出对应化学式:A______,B______,C______,D______。
(2)A在室温下与氧气反应时生成__________(写化学式,下同),D在空气中锈蚀生成__________。
(3)写出下列化学方程式:
①A在空气中燃烧______________________;
②B与氧气在加热条件下反应______________________;
③C在氧气中燃烧________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应:2NO2![]() 2NO+O2 在恒容密闭容器中反应,达到平衡状态的标志是( )
2NO+O2 在恒容密闭容器中反应,达到平衡状态的标志是( )
①单位时间内生成n molO2的同时,生成2n molNO2
②单位时间内生成n molO2 的同时,生成2n mol NO
③用NO2、NO、O2 的物质的量浓度变化表示的反应速率的比为2 : 2 : 1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥ 混合气体的平均相对分子质量不再改变的状态
A. ①④⑥ B. ②③⑤ C. ①③④ D. ①②③④⑤⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com