
| A. | FeCl3 | B. | NaHCO3 | C. | MgSO4 | D. | Na2SO3 |
分析 物质的溶液在蒸发皿中加热蒸干并灼烧,最后得到该物质固体,如果是盐,说明该物质为难挥发性酸的盐,且该盐较稳定,受热不易发生反应,据此分析解答.
解答 解:A.FeCl3易水解生成氢氧化铁和HCl,升高温度HCl易挥发,蒸干溶液得到的固体是氢氧化铁,灼烧氢氧化铁分解生成氧化铁,所以最终得到的固体是氧化铁,故A错误;
B.碳酸氢钠受热分解生成碳酸钠、二氧化碳和水,故B错误;
C.形成MgSO4的酸是硫酸,硫酸属于难挥发性酸,且硫酸镁较稳定,受热不发生反应,所以加热蒸干灼烧硫酸镁溶液最后得到的仍然是MgSO4,故C正确;
D.Na2SO3不稳定,受热易被氧气氧化为硫酸钠,所以得不到原来物质,故D错误;
故选C.
点评 本题考查盐类水解的应用,侧重考查物质性质,加热蒸干灼烧易挥发性酸的盐最终得到的物质是金属氧化物,加热蒸干灼烧难挥发性酸的盐且该盐不易发生反应时得到其物质本身.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:填空题
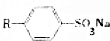
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 A、B、C都是元素周期表中的短周期元素,它们的核电荷数依次增大.第2周期元素A原子的核外成对电子数是未成对电子数的2倍,B原子的最外层p轨道的电子为半满结构,C是地壳中含量最多的元素.D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满.请用对应的元素符号或化学式填空:
A、B、C都是元素周期表中的短周期元素,它们的核电荷数依次增大.第2周期元素A原子的核外成对电子数是未成对电子数的2倍,B原子的最外层p轨道的电子为半满结构,C是地壳中含量最多的元素.D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满.请用对应的元素符号或化学式填空:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
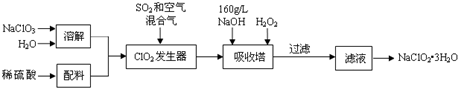
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.062 mol/L | B. | 0.62 mol/L | C. | 6.2mol/L | D. | 62mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 开发新的能源 | B. | 合成新的物质 | ||
| C. | 研究物体运动规律 | D. | 防治环境污染 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com