
����Ŀ����1������ʦ�ڴ�ѧʱ����Cl2��NaOH��(NH2)2CO�����أ���SO2Ϊԭ���Ʊ�N2H4��H2O��ˮ���£�����ˮNa2SO3������Ҫʵ���������£�

��֪����Cl2+2OHClO+Cl+H2O�Ƿ��ȷ�Ӧ��
��N2H4��H2O�е�Լ118�棬����ǿ��ԭ�ԣ�����NaClO���ҷ�Ӧ����N2��
������Ʊ�NaClO��Һʱ�����¶ȳ���40�棬Cl2��NaOH��Һ��Ӧ����NaClO3��NaCl�������ӷ���ʽΪ_____��ʵ���п����¶ȳ��ñ�ˮԡ�⣬�����ȡ�Ĵ�ʩ��_______��
��2�������ϳ�N2H4��H2O��װ����ͼ��ʾ��

NaClO������Һ������ˮ��Һ��40�����·�Ӧһ��ʱ�����Ѹ��������110�������Ӧ��ʵ����ͨ����Һ©���μӵ���Һ��_________��ʹ�������ܵ�Ŀ����_____��
��3�������Ź���ʦ�������Ϸ���AgSCNΪ��ɫ�����Ag+��������SCN����Fe2+��Ϊ̽��SCN����Fe2+�Ļ�ԭ��ǿ������ͬѧ�������ͼʵ��װ�ò���������ʵ�顣

�ȶϿ����K������ҺX�еμ�0.1mol��L-1KSCN��Һ������������˵��___________________���պϵ��K�����۲쵽��ʵ����������ҺX��졢�ұ�ʯī�缫���й���������������ָ��ƫת���ݴ˵ó��Ľ�����_____����Һ����ԭ����__________________(�����ӷ���ʽ��ʾ)����ʵ����Ƶ��ŵ���_____��
���𰸡�3Cl2+6OH===5Cl+ClO3+3H2O ����ͨ��Cl2 NaClO������Һ ����ˮ���µĻӷ� ��Һ����Fe3+ Fe2+�Ļ�ԭ��ǿ��SCN- Fe2+-e-===Fe3+��Fe3++3SCN-===Fe(SCN)3 ���������Ӻͻ�ԭ�����Ӳ�ֱ�ӽӴ������������������������Ũ�Ƚ���
��������
��1���������Cl2��NaOH��Һ��Ӧ�Ʊ�NaClO��������еķ�ӦΪNaClO������Һ������ˮ��Һ��Ӧ�Ʊ�ˮ���£�������з����ˮ������Һ���������SO2��Na2CO3��Ӧ�Ʊ�Na2SO3��
��2��Ϊ�˷�ֹˮ���±�������Ӧ��εμ�NaClO������Һ��ʹ�������ܵ�Ŀ���Ǽ���ˮ���µĻӷ���
��3���ȶϿ����K������ҺX�еμ�0.1mol��L-1KSCN��Һ������������˵����Һ����Fe3+���պϵ��K�����۲쵽��ʵ����������ҺX��졢�ұ�ʯī�缫���й���������������ָ��ƫת���ݴ˵ó��Ľ�����Fe2+�Ļ�ԭ��ǿ��SCN-����Һ����ԭ����Fe2+-e-=Fe3+��Fe3++3SCN-=Fe(SCN)3����ʵ����Ƶ��ŵ��������ԡ���ԭ�����Ӳ�ֱ�ӽӴ������������������������Ũ�Ƚ��͡�
��1���¶ȳ���40�棬Cl2��NaOH��Һ�����绯��Ӧ����NaClO3��NaCl��H2O����Ӧ�Ļ�ѧ����ʽΪ��3Cl2+6NaOH=5NaCl+NaClO3+3H2O�����ӷ���ʽΪ��
3Cl2+6OH=5Cl+ClO3+3H2O������Cl2��NaOH��Һ�ķ�ӦΪ���ȷ�Ӧ��Ϊ�˼���NaClO3�����ɣ�Ӧ�����¶Ȳ�����40�棬������Ӧ���ʣ�ʵ���п����¶ȳ��ñ�ˮԡ�⣬�����ȡ�Ĵ�ʩ�ǻ���ͨ��Cl2���ʴ�Ϊ��3Cl2+6OH=5Cl+ClO3+3H2O������ͨ��Cl2��
��2��������еķ�ӦΪNaClO������Һ������ˮ��Һ��Ӧ�Ʊ�ˮ���£�����ˮ���¾���ǿ��ԭ�ԣ�����NaClO���ҷ�Ӧ����N2��Ϊ�˷�ֹˮ���±�������Ӧ��εμ�NaClO������Һ������ͨ����Һ©���μӵ���Һ��NaClO������Һ��NaClO������Һ������ˮ��Һ��110�������Ӧ��N2H4��H2O�е�Լ118�棬ʹ�������ܵ�Ŀ���Ǽ���ˮ���µĻӷ����ʴ�Ϊ��NaClO������Һ������ˮ���µĻӷ���
��3���ȶϿ����K������ҺX�еμ�0.1mol��L-1KSCN��Һ������������˵����Һ����Fe3+���պϵ��K�����۲쵽��ʵ����������ҺX��졢�ұ�ʯī�缫���й���������������ָ��ƫת���ݴ˵ó��Ľ�����Fe2+�Ļ�ԭ��ǿ��SCN-����Һ����ԭ����Fe2+-e-=Fe3+��Fe3++3SCN-=Fe(SCN)3����ʵ����Ƶ��ŵ������������Ӻͻ�ԭ�����Ӳ�ֱ�ӽӴ������������������������Ũ�Ƚ��ͣ��ʴ�Ϊ����Һ����Fe3+��Fe2+�Ļ�ԭ��ǿ��SCN-��Fe2+-e-=Fe3+��Fe3++3SCN-=Fe(SCN)3�����������Ӻͻ�ԭ�����Ӳ�ֱ�ӽӴ������������������������Ũ�Ƚ��͡�


 Сѧѧϰ�ð���ϵ�д�
Сѧѧϰ�ð���ϵ�д� Сѧͬ�����������ܾ�ϵ�д�
Сѧͬ�����������ܾ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��C(s)��O2(g)===CO2(g)����H1
CO2(g)��C(s)===2CO(g)�� ��H2
2CO(g)��O2(g)===2CO2(g)����H3
4Fe(s)��3O2(g)===2Fe2O3(s)�� ��H4
3CO(g)��Fe2O3(s)===3CO2(g)��2Fe(s)����H5
���й���������Ӧ�ʱ���ж���ȷ����
A. ��H1��0����H3��0B. ��H2��0����H4��0C. ��H1����H2����H3D. ��H3����H4����H5
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���c��H+��=0.1mol/L��ij��Һ�п�����Na+��Fe3+��Fe2+��I����Cl����CO32���е�ij���֣���ȡ100mL����Һ��������ʵ�飺��֪������Fe3+>I2������ʵ�����������ж���ȷ���ǣ�������

A.Fe3+��I����Cl����������һ������
B.����ȷ��Na+��Cl���Ƿ���ڣ�CO32��һ��������
C.Fe3+��Fe2+������һ��
D.����Һ��c��Cl������0.3molL1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A. ����ȼ�ϵ�طŵ�ʱ��ѧ��ȫ��ת��Ϊ����
B. ��Ӧ4Fe(s)+3O2(g)![]() 2Fe2O3(s)�����¿��Է��������÷�ӦΪ���ȷ�Ӧ
2Fe2O3(s)�����¿��Է��������÷�ӦΪ���ȷ�Ӧ
C. 3 mol H2��1 mol N2��Ϸ�Ӧ����NH3��ת�Ƶ��ӵ���ĿС��6��6.02��1023
D. ��ø������ˮ�ⷴӦ�����¶�Խ�ߵ���ˮ������Խ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ��������ʵ����ʵ��������ȷ���ǣ� ��
����ϡ����ϴ��ʢ�Ź�ʯ��ˮ���Լ�ƿ
������Ũ�����Ũ����Ļ����ʱ����Ũ�����������������뵽Ũ�����У������Ͻ��裻
�������ֱַ�Na+��Mg2+��Al3+��Fe2+��Fe3+��NH4+�����ӵ���Һ��������NaOH��Һ����
����ϡ������ϴ���������Թܱ����Ag���ʣ�
�����Ƥ���ϲ���մ��Ũ���ᣬӦ�����ô�����NaOHϡ��Һ��ϴ��
��������������Fe(CrO2)2��Na2CO3�������
������ڵ�NaOHϡ��Һ�еμ�FeCl3������Һ�����Ʊ�Fe(OH)3���壻
��ij��Һ����NaOH�������ܲ���ʹʪ���ɫʯ����ֽ���������壬��ԭ��Һ�к�NH4+��
A.�٢ݢ�B.�ۢܢߢ�C.�٢ڢܢ�D.�ڢۢݢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʽ̽������Ȫʵ������ѧ��ѧ��һ����Ҫ����ʵ�飬Ҳ��һ����Ȼ���������ԭ���Ǵ���ѹǿ��Ը�����ͼ���ش��������⣺

(1)ͼ��Ϊ��ѧ��ѧ�����õ���Ȫʵ��װ�á�����ƿ�г����������壬��ͷ�ιܼ��ձ���ʢ��Һ�塣��������в������γ���Ȫ����________(����ĸ����ͬ��)
A��HCl��H2O B��O2��H2O
C��NH3��H2O D��CO2��NaOH��Һ
(2)��ͼ�ҵ���ƿ�У��ֱ�����������������ʣ���Ӧ����ܲ�����Ȫ����________��
A��Cu��ϡ����
B��NaHCO3��NaOH��Һ
C��CaCO3��ϡ����
D��NH4HCO3��ϡ����
(3)��ͼ�ҵ���ƿ���һˮ�ۣ���ƿ�м���ƾ���ˮ���м�����ˮ���ټ����������������ʣ����Ҳ��������Ȫ��ˮ���м�������ʲ�������________��
A��Ũ���� B����ʯ��
C������� D���ռ�
(4)�����г�����������Ȫ����ɽ����ԭ��������________װ�õ�ԭ�����ơ�
(5)���ֻ�ṩ��ͼ��(��ƿ�ڳ���NH3)��װ�ã�������Ȫ�ķ�����__________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij����С��ͬѧ����ͼװ�ý���ʵ�飬�Իش��������⣺
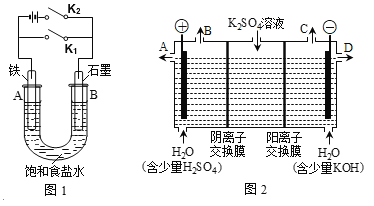
��.��ͼ1��ʵ��װ�ý���ʵ�顣
��1������ʼʱ����K2���պϿ���K1�����װ��Ϊ__________����װ�����ƣ���
��2������ʼʱ����K1���պϿ���K2����
��U�����ܷ�Ӧ�����ӷ���ʽΪ____________________��
�ڶ�������ʵ�飬����˵����ȷ����_________������ţ���
A����Һ��Na+��B���ƶ�
B����A�����ݳ���������ʹʪ���KI������ֽ����
C����Ӧһ��ʱ������������ɻָ������ǰ����ʵ�Ũ��
D������״���´�A���ݳ�2.24L���壬�����·��ͨ���ĵ�����ĿԼΪ0.2NA
��.��ͼ2��ʵ��װ�ý���ʵ�顣
��3����С��ͬѧ��Ϊ�����ģ�ҵ�����ӽ���Ĥ�����ռ�ķ�������ô������������ͼ2װ�õ���������Һ����ȡ������������������������أ������ڵ������ӽ���Ĥֻ����������ͨ���������ӽ���Ĥֻ����������ͨ������
�ٸõ��۵�������ӦʽΪ___________________����λʱ����ͨ�������ӽ���Ĥ��������______������ڡ�����С�ڡ����ڡ���ͨ�������ӽ���Ĥ����������
�ڴӳ���D��������Һ��____���ѧʽ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ܱ�������ʢ��1 mol PCl5�����ȵ�200��ʱ�����˷�Ӧ��PCl5(g) ![]() PCl3(g)��Cl2(g)����Ӧ�ﵽƽ��ʱPCl5�ķֽ���ΪM%������ͬһ�¶Ⱥ�ͬ�����������Ͷ�����2 mol PCl5����Ӧ�ﵽƽ��ʱPCl5�ķֽ���ΪN%��M��N�Ĺ�ϵ��(����)
PCl3(g)��Cl2(g)����Ӧ�ﵽƽ��ʱPCl5�ķֽ���ΪM%������ͬһ�¶Ⱥ�ͬ�����������Ͷ�����2 mol PCl5����Ӧ�ﵽƽ��ʱPCl5�ķֽ���ΪN%��M��N�Ĺ�ϵ��(����)
A. M>N B. M<N C. M��N D. ��ȷ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ClO2��һ������ɱ��Ч�ʸߡ�������ȾС��ˮ��������ʵ���ҿ�ͨ�����·�Ӧ�Ƶ�
ClO2��2KClO3+H2C2O4+H2SO4![]() 2ClO2��+2CO2��+K2SO4+2H2O������˵����ȷ���ǣ� ��
2ClO2��+2CO2��+K2SO4+2H2O������˵����ȷ���ǣ� ��
A��H2C2O4�ڷ�Ӧ�б���ԭ B��1 molKClO3�μӷ�Ӧ��2mol����ת��
C��ClO2���������� D��KClO3�ڷ�Ӧ�еõ�����
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com