
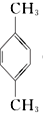
 (PX)+12MnO4-+36H+→5
(PX)+12MnO4-+36H+→5 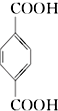 (PTA)+12Mn2++28H2O,下列有关说法错误的是( )
(PTA)+12Mn2++28H2O,下列有关说法错误的是( )| A. | PTA 是该反应的氧化产物 | |
| B. | PTA 与乙二醇通过缩聚反应即可生产 PET 塑料 | |
| C. | PX 分子含有苯环的同分异构体还有 3 种 | |
| D. | 该反应消耗 1molPX,共转移 10mol电子 |
分析 A.该反应中高锰酸根离子是氧化剂、对二甲苯是还原剂,氧化剂对应的产物是还原产物、还原剂对应的产物是氧化产物;
B.对二甲苯与乙二醇发生缩聚反应;
C.取代基可以是甲基或乙基;
D.根据Mn元素的化合价判断.
解答 解:A.反应中Mn元素的化合价降低,作氧化剂,则PX作还原剂,所以PTA是该反应的氧化产物,故A正确;
B.PTA与乙二醇通过缩聚反应即可生产PET塑料,对二甲苯与乙二醇之间不能发生加聚反应,故B错误;
C.取代基可以是甲基或乙基,二甲苯有邻间对三种,乙苯有一种,含有苯环的同分异构体还有 3 种,故C正确;
D.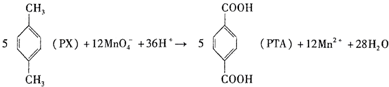 反应中,Mn元素的化合价从+7价降低到+2价,转移5个电子,则1molPX反应消耗$\frac{12}{5}$molMnO4-,共转移12NA个电子,故D错误;
反应中,Mn元素的化合价从+7价降低到+2价,转移5个电子,则1molPX反应消耗$\frac{12}{5}$molMnO4-,共转移12NA个电子,故D错误;
故选C.
点评 本题考查了共价键的类型、有机反应类型、氧化还原反应等,题目难度中等,侧重于考查学生的分析能力和对基础知识的应用能力,易错选项是D.


科目:高中化学 来源: 题型:解答题
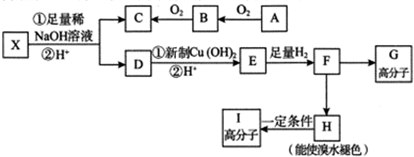
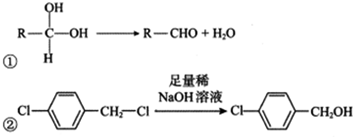
 .
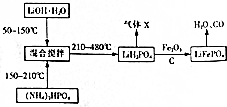
. $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$ +H2O;
+H2O;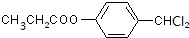 +4NaOH$→_{△}^{水}$CH3CH2COONa+
+4NaOH$→_{△}^{水}$CH3CH2COONa+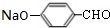 +2H2O+2NaCl;
+2H2O+2NaCl;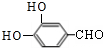 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
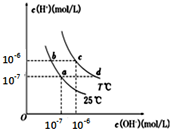
| A. | a点对应的溶液中大量存在:Na+、Mg2+、Cl-、SO42- | |
| B. | b点对应的溶液中大量存在:Fe2+、Ba2+、Cl-、NO3- | |
| C. | c点对应的溶液中大量存在:K+、Al3+、Cl-、CO32- | |
| D. | d点对应的溶液中大量存在:Na+、NH4+、ClO-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验事实 | 结论 |
| A | H2可在Cl2中燃烧产生苍白色的火焰 | 燃烧不一定有氧气参加 |
| B | 铝箔在酒精灯火焰上加热融化但不滴落 | 氧化铝熔点高于铝 |
| C | 将SO2通入酸性KMnO4溶液中,酸性KMnO4溶液褪色 | SO2具有漂白性 |
| D | 去黄豆粒大小的钠与水反应,钠熔化成闪亮的小球,浮在水面,不断游动,嘶嘶作响,最后消失 | 钠熔点低、密度比水小,放热,具有强还原性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I-=2Fe2++I2 | |
| B. | NaNO2溶液中加入酸性KMnO4溶液:2MnO4-+5NO2-+6H+=2Mn2++5NO3-+3H2O | |
| C. | NaHCO3溶液中加入过量的Ba(OH)2溶液:2HCO3-+Ba2++2OH-=BaCO3↓+2H2O+CO32- | |
| D. | FeCl3溶液腐蚀印刷电路:Fe3++Cu=Fe2++Cu2+? |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向水中加入稀氨水,水的电离平衡逆向移动,c(OH-)减小 | |
| B. | 向水中加入少量固体硫酸氢钠,c(H+)增大,KW不变 | |
| C. | 向水中加入少量固体CH3COO Na,水的电离平衡逆向移动,c(H+)减小 | |
| D. | 将水加热,KW增大,pH不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com