
(16分)等电子原理的基本观点是:原子数相同且价电子总数相等的分子或离子具有相同的化学键类型和空间构型,互称为等电子体。等电子体的结构相似,物理性质相近。如:N2、CO与C22-、CN-为等电子体。
(1)已知CaC2为离子化合物,则CaC2的电子式为 。
(2)聚丙烯腈俗称人造羊毛,由丙烯腈分子CH2=CH—CN经聚合反应生成;则CH2=CH—CN中C原子的杂化方式为 ;分子中σ键和π键数之比为 。
(3)CO常与过渡金属原子M形成配合物M(CO)n ,其中满足中心原子价电子数与配位体提供电子总数之和为18,若M为Fe,则n= 。
(4)CO与N2的结构相似,分子中含有共价三键,可表示为C≡O ;下表是两者的键能数据(单位:kJ·mol-1)
| | C-O | C=O | C≡O |
| CO | 357.7 | 798.9 | 1071.9 |
| | N-N | N=N | N≡N |
| N2 | 154.8 | 418.4 | 941.7 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
(11分)A、B、C、D四种短周期元素。原子序数依次增大,A原子的最外层上有4个电子;B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体甲;D的L层电子数等于K、M两个电子层上的电子数之和。
(1)写出下列元素的名称:A_______,B ,C_______,D 。
(2)D的质子数和中子数相等,D的原子组成符号为 ,它的最高价为___________价。
(3)用电子式表示A、D两元素形成AD2的过程: ;
写出C2B2的电子式 。
(4)氢元素与B、D 均可以形成原子个数比为2:1的化合物,H2B的熔沸点高于H2D的原因是
。
(5)写出甲和A的最高价氧化物反应的化学方式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
【化学——选修3:物质结构与性质】(15分)
卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们。
(1)卤族元素位于元素周期表的_________区;溴的价电子排布式为____________________。
(2)在一定浓度的溶液中,氢氟酸是以二分子缔合(HF)2形式存在的。使氢氟酸分子缔合的作用力是________。
(3)请根据下表提供的第一电离能数据判断,最有可能生成较稳定的单核阳离子的卤素原子是_________。
| | 氟 | 氯 | 溴 | 碘 |
| 第一电离能 (kJ/mol) | 1681 | 1251 | 1140 | 1008 |
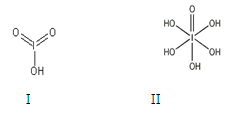
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
A、B、C都是元素周期表中的短周期非金属元素,它们的核电荷数依次增大。A原子的核外成对电子数是未成对电子数的2倍,B原子的最外层p轨道的电子为半满结构,C是地壳中含量最多的元素。D、E是第四周期元素,D原子核外最外层电子数有1个电子,其余各层电子均充满;E原子核外未成对电子数在同周期中最多。请用对应的元素符号或化学式填空:
(1)A、B、C的第一电离能由小到大的顺序为 。 A和C的氢化物沸点大小关系为 ,原因为
(2)D与E的原子化热分别为340 kJ·mol-1和400kJ·mol-1,则它们的熔点:D E(填“>”、“<”、“="”" )。
(3)分子A2B2中键与键之间的夹角为180°,并有对称性,为非极性分子,每个原子最外层电子数均满足八电子,其结构式为_____________,1mol该分子中含有 键的数目为 。
键的数目为 。
(4)基态E原子的外围电子排布式为 。EO2Cl2熔点:-96 .5℃,沸点:117℃,则固态EO2Cl2属于 晶体。
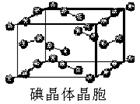
(5)D的氢化物的晶体结构如图所示,其化学式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
[化学—选修3物质结构与性质](15分)
卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们。
(1)卤族元素位于周期表的_________区;溴的价电子排布式为____________________。
(2)在不太稀的溶液中,氢氟酸是以二分子缔合(HF)2形式存在的。使氢氟酸分子缔合的作用力是________。
(3)请根据下表提供的第一电离能数据判断:最有可能生成较稳定的单核阳离子的卤素原子是_________。
| | 氟 | 氯 | 溴 | 碘 | 铍 |
| 第一电离能 (kJ/mol) | 1681 | 1251 | 1140 | 1008 | 900 |
 )和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱:H5IO6_____HIO4。(填“>”、 “<”或“=”)
)和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱:H5IO6_____HIO4。(填“>”、 “<”或“=”)

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(16分)X、Y、Z三种短周期元素,其单质在常温下均为无色气体,它们的原子序数之和为16。在适当条件下三种单质两两化合,可发生如右图所示变化。己知l个B分子中含有Z元素的原子个数比C分子中含有Z元素的原子个数少1个。请回答下列问题: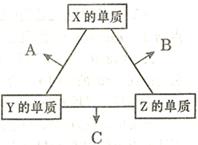
(1)由 X、Y、Z三种元素共同组成的三种不同种类的常见化合物的化学式为 ,相同浓度上述水溶液中由水电离出的c(H+)最小的是 (填写化学式)。
(2)Allis-Chalmers制造公司发现可以用C作为燃料电池的燃料,以氢氧化钾溶液为介质,反应生成对环境无污染的常见物质,试写出该电池负极的电极反应式 ,溶液中OH-向 极移动(填“正”或“负”)。
(3)Z分别与X、Y两元素可以构成18个电子分子甲和乙,其分子中只存在共价单键,常温下甲、乙均为无色液体,甲随着温度升高分解速率加快。
①乙能够将CuO还原为Cu2O,已知每lmol乙参加反应有4mole- 转移,该反应的化学方程式为 。
②将铜粉末用10%甲和3.0mol?L-1H2SO4混合溶液处埋,测得不同温度下铜的平均溶解速率如下表:
| 温度(℃) | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
| 铜的平均溶解速率 (×10-3mol?L-1·min-1) | 7.34 | 8.01 | 9.25 | 7.98 | 7.24 | 6.73 | 5.76 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(14分) X、Y、Z、W、M、Q为原子序数依次增大的六种短周期元素,常温下,六种元素的常见单质中三种为气体,三种为固体。X与M,W与Q分别同主族, X是原子半径最小的元素,且X能与Y、Z、W分别形成电子数相等的三种分子,W是地壳中含量最多的元素。试回答下列问题:
(1)W、M、Q四种元素的原子半径由大到小的排列顺序是 > > (用元素符号表示)。
(2)元素M和Q可以形成化合物M2Q,写出M2Q的电子式 。
(3) Z、W、Q三种元素的简单气态氢化物中稳定性最强的是 ,沸点最低的是 。(用分子式表示)
(4) W的一种氢化物含18个电子, 该氢化物与QW2化合时生成一种强酸,其化学方程式为 。
(5)由X、Z、W、Q四种元素中的三种元素可组成一种强酸,该强酸的稀溶液能与铜反应,则该反应的化学方程式为 。
(6)由X、Z、W、Q四种元素组成的阴阳离子个数比为1:1的化合物A,已知A既能与盐酸反应生成气体,又能与氢氧化钠的浓溶液反应生成气体,且能使氯水褪色,写出A与足量氢氧化钠溶液在加热条件下反应的离子方程式 。
(7)分子式为X2Y2W4的化合物与含等物质的量的KOH的溶液反应后所得溶液呈酸性,该溶液中各离子浓度由大到小的顺序为c(K+)> > > >c(OH-)。将2mL 0.1mol/L X2Y2W4的溶液和4mL0.01mol/L酸性KMnO4溶液混合,发现开始溶液颜色变化不明显,后溶液迅速褪色。解释原因 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(14分)(Ⅰ)、A、B、C、D、E、五种元素均是短周期元素,且原子序数依次增大。B、E原子的最外层电子数均为其电子层数的2倍。D、E元素原子的最外层电子数相等。X、Y、Z、W、G、甲、乙七种物质均由上述中的两种或三种元素组成。元素B形成的单质M与甲、乙(相对分子质量:甲<乙)浓溶液的反应分别是:甲与M反应生成X、Y、Z,乙与M反应生成Y、Z、W,反应条件均省略。回答下列有关问题:
⑴X、Y、W均能与Z反应,若将标准状况下的X和D2按4:1充满试管后将其倒立于水槽中,待水不在上升时,试管内溶质的物质的量浓度是 (假设溶质不扩散)
⑵若将X、W、D2按4:4:3通入Z中充分反应,写出总的离子方程式
⑶G是一种既能与强酸又能与强碱反应的酸式盐,则G的电子式 ,取0.2mol/L的NaOH溶液与0.1mol/L的G溶液等体积混合后,加热至充分反应后,待恢复至室温剩余溶液中离子浓度的由大到小顺序是 ,此时测得溶液的PH=12,则此条件下G中阴离子的电离平衡常数Ka =
(Ⅱ)⑷某温度时,向AgNO3溶液中加入K2CrO4溶液会生成
Ag2CrO4沉淀,Ag2CrO4在水中的沉淀溶解平衡曲线如图所示。
该温度下,下列说法正确的是_________。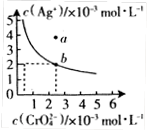
A. Ag2CrO4的溶度积常数(Ksp)为1×10-8
B. 含有大量CrO 的溶液中一定不存在Ag+
的溶液中一定不存在Ag+
C. a点表示Ag2CrO4的不饱和溶液,蒸发可以使溶液由a点变到b点
D. 0.02mol·L-1的AgNO3溶液与0.02mol·L-1的Na2CrO4溶液等体积混合会生成沉淀
⑸若常温下Ksp[Cr(OH)3]=10-32,要使c(Cr3+)降至10-5mol·L-1,溶液的pH应调至_______。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
下表为元素周期表的一部分,表中列出了11种元素在周期表中的位置,按要求完成下列各小题。
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | | | | ⑥ | | ⑦ | ⑨ | |
| 3 | ① | ③ | ⑤ | | | | ⑧ | ⑩ |
| 4 | ② | ④ | | | | | | |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com