
 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案科目:高中化学 来源: 题型:阅读理解
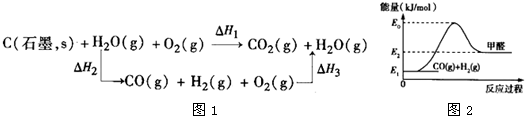
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | 相关信息 |
| A | A元素原子核外只有三个能级,且每个能级上含有相等的电子数 |
| B | 是客气中含量最丰富的元素 |
| C | 短周期元素中,C的金属性最强 |
| D | 基态原子第三能层上有7种运动状态不同的电子 |
| E | 一种核素的质量数为63,中子数为34 |
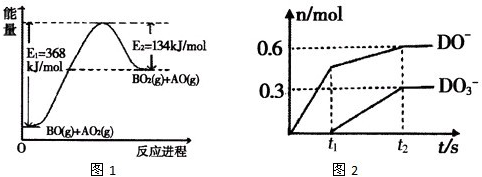
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照条件下和点燃条件下的△H不同 | B、常温下,反应2A(s)+B(g)=2C(g)+D(g)不能自发进行,则该反应的焓变一定大于零 | C、需要加热的化学反应,生成物的总能量一定高于反应物的总能量 | D、化学反应中必伴随着能量的变化,其表现形式只有热能 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com