
【题目】元素A位于第4周期,其基态原子有6个未成对电子;元素B的原子最外层电子数是其内层电子总数的3倍;元素C基态原子的3p轨道上有4个电子,元素D是有机物必不可少的中心元素,E是周期表中原子半径最小的元素。
(1)元素B与元素C可形成多种化合物。
①元素B与C中电负性较大的是______(填元素符号)。
②离子CB42—的空间构型为______(用文字描述)。
(2)B和E形成简单化合物的沸点大于C和E形成的简单化合物,其原因______。
(3)含A3+的溶液与NaCl、氨水反应可得到化合物Na[A(NH3)2Cl4]。
①基态A原子的电子排布式是______。
②1 mol配合物Na[A(NH3)2Cl4]中含σ键的数目为______mol。
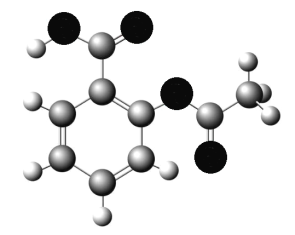
(4)下图为B、D、E三种元素形成的一种化合物的球棍模型,推测该化合物中D原子的杂化方式______。
【答案】O正四面体H2O分子间形成氢键[Ar]3d54s112sp2、sp3
【解析】
元素A位于第四周期,其基态原子有6个未成对电子,核外电子排布式为1s22s22p63s23p63d54s1,则A为Cr;元素B的原子最外层电子数是其内层电子总数的3倍则为氧元素;元素C基态原子的3p轨道上有4个电子则核外电子排布式为1s22s22p63s23p4,元素C为硫元素;元素D是有机物必不可少的中心元素则为碳元素,E是周期表中原子半径最小的元素则为氢元素。
(1)①元素B与C分别为O和S,非金属性越强电负性越大,故电负性较大的是O;
②离子CB42—为SO42-,根据价层电子对互斥理论,价层电子对个数=σ键+孤电子对个数,SO42-中中心原子S的价层电子对为![]() =4,孤电子对数为
=4,孤电子对数为![]() =0,不含孤电子对,所以空间构型是正四面体结构;
=0,不含孤电子对,所以空间构型是正四面体结构;
(2)B和E形成简单化合物H2O的沸点大于C和E形成的简单化合物H2S,其原因是H2O分子间形成氢键;
(3)含A3+的溶液与NaCl、氨水反应可得到化合物Na[Cr(NH3)2Cl4]。
①基态Cr原子的电子排布式是1s22s22p63s23p63d54s1或[Ar]3d54s1;
②单键即为σ键,1 mol配合物Na[Cr(NH3)2Cl4]中含σ键的数目为12mol;
(4)下图为B、D、E三种元素形成的一种化合物的球滚模型,推测该化合物为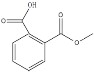 ,甲基中碳原子价层电子对个数=σ键个数+孤电子对个数=4+0=4,为sp3杂化,苯环中的碳原子、酯基中的碳原子价层电子对个数=σ键个数+孤电子对个数=3+0=3,为sp2杂化,故该化合物中D原子的杂化方式sp2、sp3。
,甲基中碳原子价层电子对个数=σ键个数+孤电子对个数=4+0=4,为sp3杂化,苯环中的碳原子、酯基中的碳原子价层电子对个数=σ键个数+孤电子对个数=3+0=3,为sp2杂化,故该化合物中D原子的杂化方式sp2、sp3。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列有关电极反应的说法正确的是
A.原电池正极和电解池阳极发生还原反应B.原电池正极和电解池阴极发生氧化反应
C.原电池负极和电解池阳极发生氧化反应D.原电池负极和电解池阴极发生还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若往20 mL 0.01 mol·L-1 HNO2(弱酸)溶液中逐滴加入一定浓度的烧碱溶液,测得混合溶液的温度变化如图所示。下列有关说法不正确的是
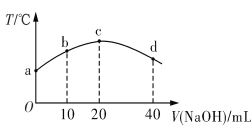
A. HNO2的电离平衡常数:c点>b点
B. b点混合溶液显酸性:c(Na+)>c(NO2-)>c(H+)>c(OH-)
C. c点混合溶液中:c(OH-)>c(HNO2)
D. d点混合溶液中:c(Na+)>c(OH-)>c(NO2-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第四周期中的18种元素具有重要的用途,在现代工业中备受青睐。
(1)铬是一种硬而脆,抗腐蚀性强的金属,常用于电镀和制造特种钢,基态Cr原子中,电子占据最高能层的符号为___,该能层上具有的原子轨道数为___。
(2)第四周期元素的第一电离能随原子序数的增大,总趋势是逐渐增大的,30Zn与31Ga的第一电离能是否符合这一规律?___(填“是”或“否”),原因是______________(如果前一问填“是”,此问可以不答)。
(3)镓与第VA族元素可形成多种新型人工半导体材料,砷化镓(GaAs)就是其中一种,其晶体结构如下图所示(白色球代表As原子).在GaAs晶体中,每个Ga原子与____个As原子相连,与同一个Ga原子相连的As原子构成的空间构型为_____;
(4)与As同主族的短周期元素是N、P.AsH3中心原子杂化的类型为____;一定压强下将AsH3、NH3和PH3的混合气体降温时首先液化的是_______,理由是__________;
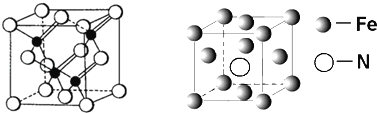
(5)铁的多种化合物均为磁性材料,氮化铁是其中一种,某氮化铁的晶胞结构如图所示,则氮化铁的化学式为________;设晶胞边长为acm,阿伏加德罗常数为NA,该晶体的密度为__g.cm﹣3(用含a和NA的式子表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1 mol CO和1 mol CO2具有相同的( )
①分子数 ②原子数 ③C原子数 ④O原子数
A. ②④ B. ①③ C. ①④ D. ①②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向MgSO4和Al2(SO4)3的混合溶液中,逐滴加入NaOH溶液。下列图像中,能正确表示上述反应的是(横坐标表示加入NaOH溶液的体积,纵坐标表示反应生成沉淀的质量) ( )

A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是( )
A. ![]() 、
、![]() 、H+和H2是氢元素的四种不同粒子
、H+和H2是氢元素的四种不同粒子
B. ![]() 和
和 ![]() 、石墨和金刚石均为同素异形体
、石墨和金刚石均为同素异形体
C. 1H和2H是不同的核素
D. 12C和14C互为同位素,物理性质不同,但化学性质几乎完全相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】空气质量评价的主要污染物为PM10、PM2.5、SO2、NO2、O3、CO等物质。研究脱硝(除NOx)技术和脱硫(除SO2)技术都是环境科学研究的热点,对于消除环境污染有重要意义。
(1)已知催化剂存在的条件下H2可以将NO还原为N2。下图是一定条件下H2还原NO生成N2和1 mol水蒸气的能量变化示意图。写出该反应的热化学方程式__________________ 。(ΔH用E1、E2、E3表示)

(2)升高温度绝大多数的化学反应速率增大,但是2NO(g)+O2(g)2NO2(g)的速率却随着温度的升高而减小。某化学小组为研究该特殊现象的实质原因,查阅资料知2NO(g)+O2(g)2NO2(g)的反应历程分两步:
I.2NO(g)N2O2(g)(快); v1正=k1正.c2(NO); v1逆=k1逆.c(N2O2) △H1<0
II.N2O2(g)+O2(g)2NO2(g)(慢); v2正=k2正.c(N2O2)c(O2); v2逆=k2逆.c2(NO2) △H2<0
请回答下列问题:
①一定温度下,反应2NO(g)+O2(g)2NO2(g)达到平衡状态,请写出用k1正、k1逆、k2正、k2逆表示的平衡常数表达式K=__________________。
②决定2NO(g)+O2(g)2NO2(g)速率的是反应 II,反应 I的活化能E1与反应 II的活化能E2的大小关系为E1___E2(填“>”、“<”或“=”)。根据速率方程分析,升高温度该反应速率减小的原因是___。
A.k2正增大,c(N2O2)增大
B.k2正减小,c(N2O2)减小
C.k2正增大,c(N2O2)减小
D.k2正减小,c(N2O2)增大
③由实验数据得到v2正~c(O2)的关系可用图表示。当x点升高到某一温度时,反应重新达到平衡,则变为相应的点为____(填字母)。

(3)我国科学家在天然气脱硫研究方面取得了新进展,利用如图装置可发生反应:H2S+O2=H2O2+S↓。

已知甲池中发生的反应为:
①装置中H+从__________ 移向__________(填“甲池”或“乙池”)。
②乙池溶液中发生的反应为______________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com