
| A. | ClO -水解平衡常数表达式为Kh=$\frac{c(HClO)•c(O{H}^{-})}{c(Cl{O}^{-})}$ | |
| B. | NH3•H2O的电离平衡常数表达式为Kb=$\frac{c(N{H}_{4}^{+})•c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$ | |
| C. | PbI2溶度积常数表达式为Ksp=c(Pb2+)•c2(I-) | |
| D. | SO2(g)+$\frac{1}{2}$O2(g)?SO3(g)的化学平衡常数表达式为K=$\frac{{c}^{2}(S{O}_{3})}{{c}^{2}(S{O}_{2})•c({O}_{2})}$ |
分析 A、次氯酸根离子结合水电离出的氢离子促进水的电离,溶液中氢氧根离子浓度增大,水解平衡常数等于生成物平衡浓度除以水解离子浓度;
B、一水合氨是弱电解质存在电离平衡,依据电离方程式书写电离平衡常数;
C、依据溶解沉淀平衡书写平衡常数;
D、化学平衡常数等于生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积;
解答 解:A、次氯酸根离子结合水电离出的氢离子促进水的电离,溶液中氢氧根离子浓度增大,ClO-+H2O?HClO+OH-,水解平衡常数等于生成物平衡浓度除以水解离子浓度,为Kh=$\frac{c(HClO)•c(O{H}^{-})}{c(Cl{O}^{-})}$,故A正确;
B、一水合氨是弱电解质存在电离平衡,NH3•H2O?NH4++OH-,依据电离方程式书写电离平衡常数为Kb=$\frac{c(N{H}_{4}^{+})•c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$,故B正确;
C、沉淀溶解判断为PbI2(s)?Pb2+(aq)+2I-(aq)溶解沉淀平衡书写PbI2溶度积常数表达式为Ksp=c(Pb2+)•c2(I-),故C正确;
D、化学平衡常数等于生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积,SO2(g)+$\frac{1}{2}$O2(g)?SO3(g)的化学平衡常数表达式为K=$\frac{c(S{O}_{3})}{c(S{O}_{2}){c}^{\frac{1}{2}}({O}_{2})}$,故D错误;
故选D.
点评 本题考查了平衡常数的概念分析,和计算表达式的书写方法应用,掌握基础是解题关键,题目较简单.


科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ③④ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)?CO(g)+H2O(g).其化学平衡常数K和温度T的关系如下表:
在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)?CO(g)+H2O(g).其化学平衡常数K和温度T的关系如下表:| T℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
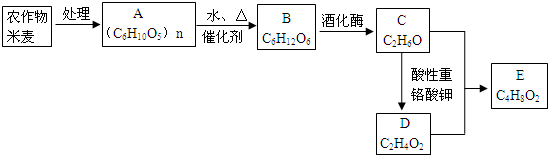
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 一定温度下,2L的密闭容器中,发生反应:A2(g)+3B2(g)?2AB3(g).A2在5min内物质的量由12mol变成了4mol.
一定温度下,2L的密闭容器中,发生反应:A2(g)+3B2(g)?2AB3(g).A2在5min内物质的量由12mol变成了4mol.| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL) | 50 | 120 | 232 | 290 | 310 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
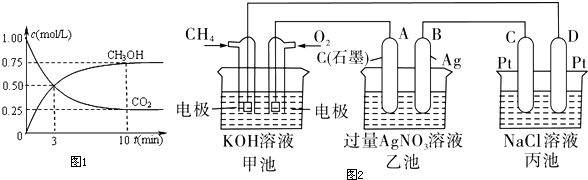
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  2,4-二硝基甲苯 2,4-二硝基甲苯 | B. | (CH3CH2)2CHCH33-甲基戊烷 | ||
| C. |  1,3-二甲基-2-丁烯 1,3-二甲基-2-丁烯 | D. |  异戊烷 异戊烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CF4>CCl4>CBr4>CI4 | B. | Na>Mg>Al | ||
| C. | SiO2>H2O>CO2 | D. | 晶体硅>SiC>金刚石 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com