
硫——碘循环分解水制氢主要涉及下列反应:
I SO2+2H2O+I2=H2SO4+2HI II 2HI ![]() H2+I2 III 2H2SO4=2SO2+O2+2H2O
H2+I2 III 2H2SO4=2SO2+O2+2H2O
(1)分析上述反应,下列判断正确的是
a.反应III易在常温下进行 b.反应I中SO2氧化性比HI强
c.循环过程中需补充H2O d.循环过程中产生1molO2的同时产生1molH2
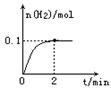 (2)一定温度下,向1L密闭容器中加入1molHI(g),发生反应II ,H2物质的量随时间的变化如图所示。
(2)一定温度下,向1L密闭容器中加入1molHI(g),发生反应II ,H2物质的量随时间的变化如图所示。
0—2min内的平均反应速率v(HI)= ;
该温度下,H2(g)+I2(g)![]() 2HI(g)的平衡常数K= 。
2HI(g)的平衡常数K= 。
相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则 是原来的2倍。
a.平衡常数 b. HI的平衡浓度 c.达到平衡的时间 d.平衡时H2的体积分数
(3)实验室用Zn和稀硫酸制取H2,反应时溶液中水的电离平衡 移动(填“向左”“向右”或“不”);若加入少量下列试剂中的 ,产生H2的速率将增大。
A.NaNO3 b.CuSO4 c.Na2SO4 d.NaHSO3
科目:高中化学 来源: 题型:
 (2010?山东)硫一碘循环分解水制氢主要涉及下列反应:
(2010?山东)硫一碘循环分解水制氢主要涉及下列反应: H2+I2
H2+I2 2HI(g)的平衡常数K=
2HI(g)的平衡常数K=查看答案和解析>>
科目:高中化学 来源: 题型:
 硫一碘循环分解水制氢主要涉及下列反应:
硫一碘循环分解水制氢主要涉及下列反应:查看答案和解析>>
科目:高中化学 来源: 题型:
(8分)硫一碘循环分解水制氢主要涉及下列反应:
Ⅰ SO2+2H2O+I2===H2SO4+2HI
Ⅱ 2HIH2+I2
Ⅲ 2H2SO4===2SO2↑+O2↑+2H2O
(1)分析上述反应,下列判断正确的是 。
a.反应Ⅲ易在常温下进行
b.反应Ⅰ中SO2氧化性比HI强
c.循环过程中需补充H2O
d.循环过程中产生1mol O2的同时产生1mol H2
(2)一定温度下,向1L密闭容器中加入1mol HI(g)
发生反应Ⅱ,H2物质的量随时间的变化如图所示。
0~2 min内的平均反应速率v(HI)= 。
该温度下,H2(g)+I2(g) 2HI(g)的平衡常数K= 。
相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则 是原来的2倍。
a.平衡常数 b.HI的平衡浓度 c.达到平衡的时间 d.平衡时H2的体积分数
(3)实验室用Zn和稀硫酸制取H2,反应时溶液中水的电离平衡 移动(填“向左”“向右”或者“不”);若加入少量下列试剂中的 ,产生H2的速率将增大。
a.NaNO3 b.CuSO4 c.Na2SO4 d.NaHSO3
(4)以H2为燃料可制成氢氧燃料电池。
已知 2H2(g)+O2(g)===2H2O(l) △H=-572KJ.mol-1
某氢氧燃料电池释放228.8KJ电能时,生成1mol液态水,该电池的能量转化率为 。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年山东省青岛市城阳区高三上学期学分认定考试化学试卷(解析版) 题型:填空题
硫一碘循环分解水制氢的主要反应如下:

(1)上述循环反应的总反应可以表示为____________________;反应过程中起催化作用的物质是__________(选填编号)。
a. ???????? b.
???????? b. ???????? c.
???????? c. ????? d.HI
????? d.HI
(2)一定温度下,向2L密闭容器中加入1molHI(g),发生反应II, 的物质的量随时间的变化如图所示。0~2min内的平均反应速率
的物质的量随时间的变化如图所示。0~2min内的平均反应速率 _________。
_________。

(3)对反应II,在相同温度和体积下,若开始加入的HI(g)的物质的量是原来的2倍,则以下_________也是原来的2倍(选填编号),
a.平衡常数??????????? b.HI的平衡浓度
c.达到平衡时间???????? d.平衡时 的体积分数
的体积分数
(4)实验室用锌和稀硫酸反应制取 ,反应时溶液中水的电离平衡______移动(选填“向左”、“向右”或“不”);若加入少量下列试剂中的_____(选填编号),产生
,反应时溶液中水的电离平衡______移动(选填“向左”、“向右”或“不”);若加入少量下列试剂中的_____(选填编号),产生 的速率将增大。
的速率将增大。
a. ????? b.
????? b. ????? c.
????? c. ????? d.
????? d.
查看答案和解析>>
科目:高中化学 来源:2014届四川省绵阳市高二12月月考化学试卷(解析版) 题型:填空题
硫-碘循环分解水制氢主要涉及下列反应:
Ⅰ.SO2+2H2O+I2=H2SO4+2HI Ⅱ. 2HI H2+I2(g)
H2+I2(g)
Ⅲ. 2H2SO4=2SO2+O2+2H2O
(1)分析上述反应,下列判断正确的是 。
a.反应Ⅲ易在常温下进行
b.反应Ⅰ中SO2氧化性比HI强
c.循环过程中需补充H2O
d.循环过程中产生1 mol O2的同时产生1 mol H2
(2)一定温度下,向1 L密闭容器中加入1 mol HI(g),发生反应Ⅱ,H2物质的量随时间的变化如右图所示。那么,0~2 min内的平均反应速率:υ(HI)= 。

相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则 是原来的2倍。
a.压强 b.HI的平衡浓度
c.达到平衡的时间 d.平衡时H2的体积分数
(3)用足量Zn和一定量的硫酸制取H2,反应时溶液中水的电离
(H2O H++OH-)平衡 移动(填“向左”“向右”或者“不”);若要减小产生H2的速率而又不影响产生H2的总量,应向硫酸中加入下列试剂中的
。
H++OH-)平衡 移动(填“向左”“向右”或者“不”);若要减小产生H2的速率而又不影响产生H2的总量,应向硫酸中加入下列试剂中的
。
a.Na2CO3溶液 b.K2SO4溶液 c.NaNO3溶液 d.水 e.CuSO4溶液
(4)以H2为燃料制成燃料电池,若:2H2(g)+O2(g)=2H2O(l) ΔH=-572 kJ/mol,
当电池释放228.8 kJ电能时,生成1 mol液态水,该电池的能量转化率为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com