
| A. | ①③④⑤ | B. | ①②③④⑤⑦ | C. | ①③④⑤⑧ | D. | ①②③④⑤⑥⑦⑧ |
分析 反应到达平衡状态时,正逆反应速率相等,平衡时各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,由此进行判断.
解答 解:①该反应是反应前后气体体积入发生变化的反应,所以容器中的压强不再发生变化,能证明达到了平衡状态,故①正确;
②从反应发生混合气体的密度就一直不发生变化,不能表明达到化学平衡状态,故②错误;
③反应达到平衡状态时,正逆反应速率相等,平衡时各种物质的浓度等不再发生变化,所以各气体物质的物质的量浓度不再变化时,该反应达到平衡状态,故③正确;
④体总物质的量不变,说明正逆反应速率相等,故④正确;
⑤气混合气体的平均相对分子质量不变,说明总物质的量不变,能表明反应达到平衡状态,故⑤正确;
⑥只要反应发生v(C)与v(D)的比值就一定,故⑥错误;
⑦混合气体的总质量一直不变,故⑦错误;
⑧在恒温恒容容器中,所以混合气体的总体积一直不变,故⑧错误;
故选:A.
点评 本题考查化学平衡状态的判断,难度不大,注意只有反应前后不相同的量才能作为判断化学平衡的依据,反应前后不改变的量不能作为判断化学平衡的依据,如该反应中的压强就不能作为判断化学平衡的依据.


 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ①③ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 W、X、Y和Z是常见的短周期元素,其原子半径随原子序数变化如图所示.己知W的一种核素的质量数为18,中子数为10;X和Ne的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期主族元素中最大.
W、X、Y和Z是常见的短周期元素,其原子半径随原子序数变化如图所示.己知W的一种核素的质量数为18,中子数为10;X和Ne的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期主族元素中最大.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢化物稳定性:Y>Z | |
| B. | XW3与WZ相遇,产生大量白烟 | |
| C. | 氧化物的水化物的酸性:Y<Z | |
| D. | X与Z不能同时存在于同一离子化合物中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
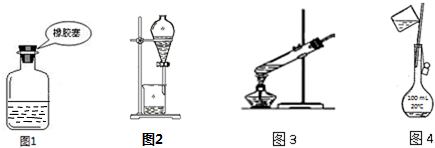
| A. | 图1装置:存放NaOH溶液 | |
| B. | 图2装置:分离乙酸乙酯和水 | |
| C. | 图3装置:葡萄糖的银镜反应 | |
| D. | 图4装置:配制 100 mL 1 mol/L NaCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 镁在空气中和纯净氧气中的燃烧产物只有MgO | |
| B. | 硫在空气中的燃烧产物是SO2,在纯净氧气中的燃烧产物是SO3 | |
| C. | 钠在敞口容器中长期放置和在空气中燃烧的产物都是Na2O2 | |
| D. | 浓H2SO4和浓盐酸敞口放置在空气中,其溶质的质量分数都将减小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com