
| A. | 氦气可用于填充飞艇 | B. | 氯化铁可用于硬水的软化 | ||
| C. | 石英砂可用于生产单晶硅 | D. | 聚四氟乙烯可用于厨具表面涂层 |
分析 A.根据氦气的密度小于空气的密度判断;
B.氯化铁不能与钙离子、镁离子反应;
C.二氧化硅与焦炭反应生成硅与一氧化碳;
D.不粘锅表面涂层的主要成分为聚四氟乙烯.
解答 解:A.气球内其他的密度必须比空气密度小,氦气的密度小于空气的密度,并且化学性质稳定,不易和其它物质发生反应,氦气可用于填充气球,故A正确;
B.氯化铁不能与钙离子、镁离子反应,不能降低钙离子、镁离子浓度,所以不能用于硬水的软化,故B错误;
C.二氧化硅与焦炭反应生成硅与一氧化碳,所以石英砂可用于生产单晶硅,故C正确;
D.不粘锅表面涂层的主要成分为聚四氟乙烯,故D正确;
故选:B.
点评 本题考查了元素化合物知识,涉及物质的性质及用途,性质决定用途,明确物质的性质是解题关键,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. |  的分子式为C7H12O 的分子式为C7H12O | |
| B. | 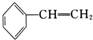 的所有原子一定在同一平面上 的所有原子一定在同一平面上 | |
| C. |  能发生还原反应、氧化反应和取代反应 能发生还原反应、氧化反应和取代反应 | |
| D. |  的二氯代物有15种 的二氯代物有15种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 负极反应为:14H2O+7O2+28e-═28OH- | |
| B. | 放电过程中KOH的物质的量浓度不变 | |
| C. | 每消耗1molC2H6,则电路上转移的电子为14mol | |
| D. | 放电一段时间后,负极周围的pH升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

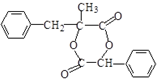 .
.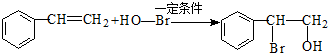 .
. 和
和 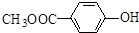 .
.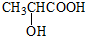 ) 的合成线路
) 的合成线路 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Li-Al在电池中作为负极材料,该材料中Li的化合价为+l价 | |
| B. | 用水作电解质溶液 | |
| C. | 该电池的电池反应式为:2Li+FeS═Li2S+Fe | |
| D. | 充电时,阴极发生的电极反应式为:Li2S+Fe-2e-═2Li++FeS |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可生成H2的质量为0.02g | |
| B. | 可生成氢的原子数为2.408×1023个 | |
| C. | 可生成H2的体积为0.224L(标准情况) | |
| D. | 生成H2的量理论上等于0.04mol Na与水反应产生H2的量 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 X、Y、Z、W、R、Q为前30号元素,且原子序数依次增大.X的最高正价和最低负价的绝对值相等,Y有三个能级,且每个能级上的电子数相等,Z原子未成对电子数在同周期元素中最多,W与Z同周期,第一电离能比Z的低,R与Y同一主族,Q的最外层只有一个电子,其他电子层电子均处于饱和状态.请回答下列问题:
X、Y、Z、W、R、Q为前30号元素,且原子序数依次增大.X的最高正价和最低负价的绝对值相等,Y有三个能级,且每个能级上的电子数相等,Z原子未成对电子数在同周期元素中最多,W与Z同周期,第一电离能比Z的低,R与Y同一主族,Q的最外层只有一个电子,其他电子层电子均处于饱和状态.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X、W、U的最高价氧化物对应的水化物酸性由强到弱的顺序为:U>W>X | |
| B. | Y、Z元素的单质作电极,在氢氧化钠溶液中构成原电池,Z电极上产生大量气泡 | |
| C. | 室温下,0.05.mol•L-1U的气态氢化物的水溶液的pH>1 | |
| D. | Y、Z、U元素的简单离子半径由大到小的顺序:Y>Z>U |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com