
ij�¶������ݻ�Ϊ 2L ���ܱ������У�������Ӧ 2X(g) + Y(g)  2W(g)����H��0�������� 2 mol X �� 1 mol Y����20 s�ﵽƽ��ʱ������ 0.4 molW������˵����ȷ���ǣ���
2W(g)����H��0�������� 2 mol X �� 1 mol Y����20 s�ﵽƽ��ʱ������ 0.4 molW������˵����ȷ���ǣ���
�������¶ȣ�W �����������С����H ����
���� Y ��Ũ�ȱ仯��ʾ�ķ�Ӧ����Ϊ 0.01 mol/(L·s)
���������������������£����� 1 mol X ���� X �� Y ��ת���ʾ����
������ѹǿ������Ӧ���������淴Ӧ���ʼ�С����ƽ��������Ӧ�����ƶ�
������������ͨ�� 2 mol X �� 1 mol Y���ﵽƽ��ʱ��X��Y ��ת���ʾ�����
A���٢� B���� C���ڢۢ� D���ܢ�
��֪ʶ�㡿��ѧ��Ӧ�����뻯ѧƽ�� G1 G2
���𰸽�����B�����������¶ȣ�W�����������С����ƽ�������ƶ�������H���䣬��Ϊ��H�뷽��ʽ��д���йأ�����ʽȷ������Hȷ�����ٴ��� ��W��Ũ�ȱ仯��ʾ�ķ�Ӧ����v=0.4mol/2L·20s=0.01mol/��L•s����������Y��ʾ�ķ�Ӧ����0.005 mol/��L•s�����ڴ�������X������ƽ�������ƶ�����X��ת���ʻ��С��Y��ת�������۴�������ѹǿ�����淴Ӧ���ʶ��ӿ죬ƽ�������������С�ķ����ƶ�������������Ӧ�����ƶ����ܴ�������������ͨ�� 2 mol X �� 1 mol Y���൱�Ƕ�ԭƽ���ѹ��ƽ�������ƶ����ﵽƽ��ʱ��X��Y ��ת���ʾ�������ȷ��ѡB��
��˼·�㲦��ƽ�ⷢ���ƶ�������˵��Ӧ�ȷ����仯����Ӧ��ֻ�뷽��ʽ��д���йء�


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д� Ŀ�����ϵ�д�
Ŀ�����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
2008�걱���а»Ἢ��������ţΪ������Ƶġ���ţ���֡�(Funiulele)����һ���л���ļ���ʽҲ����ţ���ʳ�Ϊţʽ��ϩȲ��(cowenynenynol)�������й�˵������ȷ����(����)

A��ţʽ��ϩȲ�������ں������ֹ�����
B��ţʽ��ϩȲ���ܹ������Ӿ۷�Ӧ�õ��߷��ӻ�����
C��ţʽ��ϩȲ����һ���������������ᷢ��������Ӧ
D��ţʽ��ϩȲ����ʹ���Ը��������Һ��ɫ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
)����ȼ�ϵ����Ŀǰ��Ϊ�����ȼ�ϵ�أ��������ɺͷ�Ӧԭ�����¡�

��1���ڸ���������Ҫ�����ķ�ӦΪ_______________________________
��2����λ��Ӧ����CO(g)+H2O (g)  CO2 (g)+H2(g) ����һ���¶��£���1L�����з���������Ӧ�������ʵ����ʵ���Ũ�ȱ仯���±���
CO2 (g)+H2(g) ����һ���¶��£���1L�����з���������Ӧ�������ʵ����ʵ���Ũ�ȱ仯���±���
| t/min | COmol/L) | H2O(mol/L) | CO2(mol/L) | H2(mol/L) |
| 0 | 0.2 | 0.3 | 0 | 0 |
| 2 | n1 | n2 | n3 | 0.1 |
| 3 | n1 | n2 | n3 | 0.1 |
| 4 | 0.09 | 0.19 | 0.11 | 0.11 |
�ٴ��¶��£��÷�Ӧ��ƽ�ⳣ��Ϊ________
�ڷ�Ӧ��3��4 min֮�䣬���������ʵ��������ԭ������� ������ţ�
A������ˮ���� B�������¶� C��ʹ�ô��� D����������
��3������ȼ�ϵ�ظ����ų���������Ҫ��___ __��
�õ�������ĵ缫��ӦΪ_ _ __��
��4������ȼ�ϵ�صĵ缫�϶��˲��ۣ���������Ŀ�ģ��������õĵ��������⣬���߱��������� ��
��5�����忴����������ϵ������������CxHy������ķ�Ӧ������CxHyΪ���飬��
��֪�����ȼ����Ϊ5 518 kJ·mol��1����д������ȼ���ȵ��Ȼ�ѧ����ʽ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
һ���¶��£������������Ϊ1.0L�ĺ����ܱ������з�����Ӧ��2CH3OH(g) CH3OCH3(g)��H2O(g)��������˵����ȷ���� �� ��
CH3OCH3(g)��H2O(g)��������˵����ȷ���� �� ��
| ���� ��� | �¶ȣ��棩 | ��ʼ���ʵ�����mol�� | ƽ�����ʵ�����mol�� | |
| CH3OH(g) | CH3OCH3(g) | H2O(g) | ||
| I | 387 | 0.20 | 0.080 | 0.080 |
| �� | 387 | 0.40 | ||
| �� | 207 | 0.20 | 0.090 | 0.090 |
A���÷�Ӧ��������ӦΪ���ȷ�Ӧ
B���ﵽƽ��ʱ������I�е�CH3OH����������������С
C������I�з�Ӧ�ﵽƽ������ʱ����������еij�
D������ʼʱ������I�г���CH3OH 0.1mol��CH3OCH3 0.15mol��H2O 0.10mol����Ӧ��������Ӧ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
SiCl4��������Ϊ��ɫҺ�壬�ӷ�����ǿ�ҵĴ̼��ԡ���SiCl4��ת��ΪSiHCl3���پ�������ԭ���ɸߴ��衣һ�������£���20L�����ܱ������з���SiCl4ת��ΪSiHCl3 �ķ�Ӧ��3SiCl4(g)��2H2(g)��Si(s) 4SiHCl3(g)����H��Q kJ·mol��1��2 min��ﵽƽ�⣬H2��SiHCl3�����ʵ���Ũ�ȷֱ�Ϊ0.1 mol·L��1��0.2 mol·L��1��
4SiHCl3(g)����H��Q kJ·mol��1��2 min��ﵽƽ�⣬H2��SiHCl3�����ʵ���Ũ�ȷֱ�Ϊ0.1 mol·L��1��0.2 mol·L��1��
��1���ӷ�Ӧ��ʼ��ƽ�⣬v(SiCl4)�� ��
��2���÷�Ӧ��ƽ�ⳣ������ʽΪK�� ���¶����ߣ�Kֵ������Q 0(�����������������)��
 ��3����ƽ������������г�������ʼʱ������SiCl4��H2(����Si����)������Ӧ�ٴδﵽƽ��ʱ����ԭƽ����Ƚϣ�H2����������� (���������С�����䡱)��
��3����ƽ������������г�������ʼʱ������SiCl4��H2(����Si����)������Ӧ�ٴδﵽƽ��ʱ����ԭƽ����Ƚϣ�H2����������� (���������С�����䡱)��
��4��ԭ�����У�ͨ��H2�����(��״����)Ϊ ��
��5��ƽ��������������Ϊ10 L���ٴδﵽƽ��ʱ��
H2�����ʵ���Ũ�ȷ�ΧΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
ˮ��������Դ֮һ�����б�����ȷ����(����)
A��H2O�ĵ���ʽΪH��[
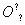
 H]��
H]��
B��4��ʱ����ˮ��pH��7
C��D O�У�������֮����������֮�͵�����
O�У�������֮����������֮�͵�����
D��273 K��101 kPa��ˮ���Ӽ��ƽ������d��d(��̬)>d(Һ̬)>d(��̬)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��1 mL 0.1 mol��L��1��H2SO4��ˮϡ���Ƴ�2 L��Һ���ڴ���Һ����ˮ���������H����Ũ�Ƚӽ���(����)
A��1��10��4 mol��L��1 B��1��10��8 mol��L��1
C��1��10��11 mol��L��1 D��1��10��10 mol��L��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���ξۺ���SPLA�ɾ����з�Ӧ·�ߵõ�(���ַ�Ӧ����δע��)��

��֪��SPLA�Ľṹ��ʽΪ
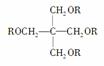 ������RΪ
������RΪ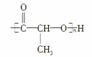
(1)������________��(������ࡱ)��A��������____________��
(2)��ȩ�ɲ��������Ʊ��ķ���֮һ��
________________________________________________________________________
________________________________________________________________________(�û�ѧ����ʽ��ʾ���ɶಽ)��
(3)D��E�Ļ�ѧ��Ӧ��������________��Ӧ��D�ṹ����3����ͬ�Ļ��ţ���1 mol D����2 mol Ag(NH3)2OH��Ӧ����D�Ľṹ��ʽ��____________��D��������Һ��Ӧ�Ļ�ѧ����ʽΪ________________________________________________________________________
________________________________________________________________________��
(4)B��ֱ��ͬ���칹��G�ķ����в�������G�Ȳ�����NaHCO3��Һ��Ӧ���ֲ���������Cu(OH)2����Һ��Ӧ����1 mol G������Na��Ӧ����1 mol H2����G�Ľṹ��ʽΪ________________________________________________________________________��
(5)B�ж�����ˮ����������ֲ���Ľṹ��ʽΪ____________________��
____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�ڻ�̬�����ԭ���У����ں����������������������� (����)��
A������ʧȥ�ĵ����������
B����������С�ĵ����������
C��p�����������һ������s�����������
D�����������������˶��ĵ����������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com