
【题目】聚合硫酸铁[Fe2(OH)6-2n(SO4)n]m广泛用于水的净化。以FeSO4·7H2O为原料,经溶解、氧化、水解聚合等步骤,可制备聚合硫酸铁。
(1)将一定量的FeSO4·7H2O溶于稀硫酸,在约70 ℃下边搅拌边缓慢加入一定量的H2O2溶液,继续反应一段时间,得到红棕色黏稠液体。H2O2氧化Fe2+的离子方程式为________;水解聚合反应会导致溶液的pH________。
(2)测定聚合硫酸铁样品中铁的质量分数:准确称取液态样品3.000 g,置于250 mL锥形瓶中,加入适量稀盐酸,加热,滴加稍过量的SnCl2溶液(Sn2+将Fe3+还原为Fe2+),充分反应后,除去过量的Sn2+。用5.000×102 mol·L1 K2Cr2O7溶液滴定至终点(滴定过程中![]() 与Fe2+反应生成Cr3+和Fe3+),消耗K2Cr2O7溶液22.00 mL。
与Fe2+反应生成Cr3+和Fe3+),消耗K2Cr2O7溶液22.00 mL。
①上述实验中若不除去过量的Sn2+,样品中铁的质量分数的测定结果将________(填“偏大”或“偏小”或“无影响”)。
②计算该样品中铁的质量分数(写出计算过程)_____。
【答案】2Fe2++ H2O2+2H+![]() 2Fe3++2H2O 减小 偏大 n(
2Fe3++2H2O 减小 偏大 n(![]() )=5.000×102 mol·L1×22.00 mL×103 L·mL1=1.100×103 mol
)=5.000×102 mol·L1×22.00 mL×103 L·mL1=1.100×103 mol
由滴定时![]() →Cr3+和Fe2+→Fe3+,根据电子得失守恒可得微粒的关系式:
→Cr3+和Fe2+→Fe3+,根据电子得失守恒可得微粒的关系式:![]() ~6Fe2+
~6Fe2+
(或![]() +14H++6Fe2+
+14H++6Fe2+![]() 6Fe3++2Cr3++7H2O)
6Fe3++2Cr3++7H2O)
则n(Fe2+)=6n(![]() )=6×1.100×103 mol=6.600×103 mol
)=6×1.100×103 mol=6.600×103 mol
样品中铁元素的质量:
m(Fe)=6.600×103 mol×56 g·mol1=0.3696 g
样品中铁元素的质量分数:w(Fe)=![]() ×100%=12.32%
×100%=12.32%
【解析】
(1)Fe2+具有还原性,H2O2具有氧化性,根据得失电子守恒、原子守恒和电荷守恒书写离子方程式;根据水解反应的离子方程式分析溶液pH的变化;
(2)①根据Sn2+能将Fe3+还原为Fe2+判断还原性的强弱,进一步进行误差分析;
②根据K2Cr2O7溶液的浓度和体积计算消耗的K2Cr2O7物质的量,由得失电子守恒计算n(Fe2+),结合Fe守恒和ω(Fe)的表达式计算。
(1)Fe2+具有还原性,在溶液中被氧化成Fe3+,H2O2具有氧化性,其还原产物为H2O,根据得失电子守恒可写出反应2Fe2++H2O2→2Fe3++2H2O,根据溶液呈酸性、结合原子守恒和电荷守恒,H2O2氧化Fe2+的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O;H2O2氧化后的溶液为Fe2(SO4)3溶液,Fe2(SO4)3发生水解反应Fe2(SO4)3+(6-2n)H2O![]() Fe2(OH)6-2n(SO4)n+(3-n)H2SO4,Fe2(OH)6-2n(SO4)n聚合得到聚合硫酸铁,根据水解方程式知水解聚合反应会导致溶液的酸性增强,pH减小。答案:2Fe2++H2O2+2H+=2Fe3++2H2O 减小
Fe2(OH)6-2n(SO4)n+(3-n)H2SO4,Fe2(OH)6-2n(SO4)n聚合得到聚合硫酸铁,根据水解方程式知水解聚合反应会导致溶液的酸性增强,pH减小。答案:2Fe2++H2O2+2H+=2Fe3++2H2O 减小
(2)①根据题意,Sn2+能将Fe3+还原为Fe2+,发生的反应为Sn2++2Fe3+=Sn4++2Fe2+,根据还原性:还原剂>还原产物,则还原性Sn2+>Fe2+,实验中若不除去过量的Sn2+,则加入的K2Cr2O7先氧化过量的Sn2+再氧化Fe2+,导致消耗的K2Cr2O7溶液的体积偏大,则样品中铁的质量分数的测定结果将偏大。答案:偏大
② 实验过程中消耗的n(Cr2O72-)=5.000×10-2mol/L×22.00mL×10-3L/mL=1.100×10-3mol
由滴定时Cr2O72-→Cr3+和Fe
则n(Fe2+)=6n(Cr2O72-)=6×1.100×10-3mol=6.6×10-3mol
(根据Fe守恒)样品中铁元素的质量:m(Fe)=6.6×10-3mol×56g/mol=0.3696g
样品中铁元素的质量分数:ω(Fe)=![]() ×100%=12.32%。
×100%=12.32%。


科目:高中化学 来源: 题型:
【题目】氨是化肥工业和基本有机化工的主要原料,工业采用N2和H2合成氨的催化过程如下图所示。已知合成氨的反应为放热反应,下列说法正确的是
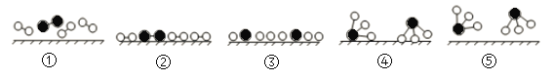
A.使用催化剂可改变反应的△H
B.过程③到④形成N—H吸收能量
C.升高温度,合成氨反应的平衡常数减小
D.催化剂可有效提高反应物的平衡转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeBr2是一种黄绿色固体,某学习小组制备并探究它的还原性。
I.实验室制备FeBr2实验室用如图所示装置制取溴化亚铁。其中A为CO2发生装置,D和d中均盛有液溴,E为外套电炉丝的不锈钢管,e是两个耐高温的瓷皿,其中盛有细铁粉。
实验开始时,先将铁粉加热至600—700℃,然后将干燥、纯净的CO2气流通入D中,E管中反应开始。不断将d中液溴滴入温度为100—120℃的D中。经过几小时的连续反应,在铁管的一端沉积有黄绿色鳞片状溴化亚铁。
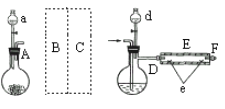
(1)若在A中盛固体CaCO3,a中盛6 mol/L盐酸。为使导入D中的CO2为干燥纯净的气体,则图中B、C处的装置和其中的试剂应是:B为_____________。C为________________。为防止污染空气,实验时应在F处连接盛___________的尾气吸收装置。
(2)反应过程中要不断通入CO2,其主要作用是____________________。
Ⅱ.探究FeBr2的还原性
(3)实验需要200 mL 0.1 mol/L FeBr2溶液,配制FeBr2溶液除烧杯、量筒、胶头滴管、玻璃棒外,还需要的玻璃仪器是_____________,需称量FeBr2的质量为:_________。
(4)取10 mL上述FeBr2溶液,向其中滴加少量新制的氯水,振荡后溶液呈黄色。某同学对产生黄色的原因提出了假设:
假设1:Br一被Cl2氧化成Br2溶解在溶液中;
假设2:Fe2+被Cl2氧化成Fe3+
设计实验证明假设2是正确的:________
(5)请用一个离子方程式来证明还原性Fe2+>Br一________:
(6)若在40 mL上述FeBr2溶液中通入3×10-3mol Cl2,则反应的离子方程式为________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在体积为10L的密闭容器中充入1mol X和1mol Y进行反应:2X(g)+Y(g)![]() Z(g),60s后反应达到平衡,生成Z的物质的量为0.3mol。下列说法正确的是
Z(g),60s后反应达到平衡,生成Z的物质的量为0.3mol。下列说法正确的是
A.X的平衡转化率为40%
B.若将容器体积变为20L,则Z的平衡浓度小于原来的![]()
C.若增大压强,则Y的平衡转化率减小
D.若升高温度,X的体积分数增大,则该反应的ΔH>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,下列说法正确的是
A.醋酸分子不可能存在于pH>7的碱性溶液中
B.NaCl溶液与CH3COONH4溶液均呈中性,所以等物质的量浓度的两种溶液中水的电离程度相等。
C.0.1mol·L-1硫化钠溶液中粒子浓度的关系:c(OH-)- c(H+)=c(HS-)+c(H2S)
D.同浓度的溶液:①(NH4)2SO4、②NH4HSO4、③NH4Cl中,c(NH4+)由大到小的顺序是①>②>③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两种金属接触时,接触部位会发生“电偶腐蚀”。金属铁和铜在自来水和海水中,相同时间发生的腐蚀情况如图。下列有关说法正确的是( )

A.甲图中的介质为海水
B.腐蚀过程中电能转化为化学能
C.铁电极反应式为Fe-3e-=Fe3+
D.若在金属表面涂油漆,可以减弱铁的腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)NH4Al(SO4)2可作净水剂,其理由是__________________(用必要的化学用语和相关文字说明).
(2)常温下0.1 mol·L-1的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是________(填字母序号,下同)。
A.c(H+) B.![]()
C.c(H+)·c(OH-) D.![]()
E.![]()
若该溶液升高温度,上述5种表达式的数据一定增大的是___________。
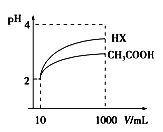
(3)体积为10mL pH=2的醋酸溶液与一元酸HX溶液分别加水稀释至1 000mL,稀释过程pH变化如图:则HX的电离平衡常数_____________(填“大于”、“等于”或“小于”)醋酸的平衡常数;理由是____________________;稀释后,HX溶液中由水电离出来的c(H+)___________(填“大于”、“等于”或“小于”)醋酸溶液中由水电离出来的c(H+)。
(4)已知25℃,NH3·H2O的Kb=1.8×105,H2SO3的Ka1=1.3×102,Ka2=6.2×108。将SO2通入该氨水中,当c(OH)降至1.0×107 mol·L1时,溶液中的![]() =____________。
=____________。
(5)①25℃时,Ka(HCN)=4.9×l0-10,Ka(CH3COOH)=1.8×l0-5,H2CO3:K1=4.3×l0-7、K2=5.6×l0-11,25℃时有pH相等的NaCN溶液、Na2CO3溶液、CH3COONa溶液,三溶液的物质的量浓度由大到小的顺序为_____________.
②向NaCN溶液中通入少量CO2,所发生反应的化学方程式为:_______________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用pH=m的盐酸滴定20mL pH=n的MOH溶液,且m+n=14。混合溶液的pH与盐酸体积V的关系如图所示。下列说法正确的是( )

A.a点:c(Cl-)>c(M+)>c(OH-)>c(H+)
B.b点:MOH和HCl恰好完全反应
C.c点:c(H+)=c(OH-)+c(MOH)
D.a点到d点:水电离的c(H+)·c(OH-)先变大,后变小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应:2NO2![]() 2NO+O2在密闭容器反应,达到平衡状态的标志是()
2NO+O2在密闭容器反应,达到平衡状态的标志是()
(1)单位时间内生成n mol O2的同时生成2n mol NO2
(2)单位时间内生成n mol O2的同时生成2n mol NO
(3)用NO2、NO、O2的物质的量浓度变化表示反应速率的比为2:2:1的状态
(4)混合气体的颜色不再改变的状态
(5)混合气体的平均相对分子质量不再改变的状态.
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com