
分析 析氢腐蚀和吸氧腐蚀的负极均为Fe失去电子,析氢腐蚀的正极反应为氢离子得到电子,吸氧腐蚀的正极反应为氧气得到电子,以此来解答.
解答 解:析氢腐蚀和吸氧腐蚀的本质相同,该腐蚀过程中负极电极反应式为Fe-2e-=Fe2+,但正极反应不同,析氢腐蚀的正极反应为2H++2e-=H2↑,钢铁腐蚀主要是吸氧腐蚀,吸氧腐蚀的正极反应为O2+2H2O+4e-=4OH-,
故答案为:Fe-2e-=Fe2+;2H++2e-=H2↑;O2+2H2O+4e-=4OH-.
点评 本题考查电化学腐蚀,为高频考点,把握原电池原理的应用、电极反应的书写为解答的关键,侧重分析与应用能力的考查,注意正极反应的区别,题目难度不大.


 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:选择题
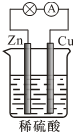
| A. | 反应一段时间后,溶液的酸性减弱 | |
| B. | 电子由Zn经外电路流向Cu,再经硫酸溶液流回Zn | |
| C. | 负极的反应式为2H++2e-═H2↑ | |
| D. | 硫酸作电解质起导电的作用,故浓度保持不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
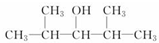 B.
B.
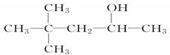 D.CH3(CH2)5CH2OH
D.CH3(CH2)5CH2OH查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 原混合气体中O2和CH4的体积比为2:1 | |
| B. | 残留物中只有Na2CO3 | |
| C. | 原混合气体中O2和CH4的物质的量之比为1:2 | |
| D. | 残留物只有Na2CO3和NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O2的电子式:H+[${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$]2-H+ | |
| B. | 次氯酸的结构式:H-O-Cl | |
| C. | S2-的结构示意图: | |
| D. | CO2的比例模型: |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com