
| A. | PH=3的盐酸和PH=11的氨水 | B. | PH=3的硝酸和PH=11的Ba(OH)2溶液 | ||
| C. | PH=3的硫酸和PH=11的氨水 | D. | PH=3的醋酸和PH=11的Ba(OH)2溶液 |
分析 A.盐酸是强电解质、NH3.H2O是弱电解质,pH=3的硝酸浓度小于pH=11的氨水,二者等体积混合,氨水有剩余;
B.硝酸和氢氧化钡都是强电解质,pH=3的硝酸中c(H+)等于Ba(OH)2中c(OH-),二者等体积混合,酸碱恰好反应生成强酸强碱盐;
C.硫酸是强电解质、NH3•H2O是弱电解质,pH=3的硫酸浓度小于pH=11的氨水,二者等体积混合,氨水有剩余;
D.醋酸是弱电解质、Ba(OH)2是强电解质,pH=3的醋酸浓度大于pH=11的Ba(OH)2浓度,而等体积混合醋酸有剩余.
解答 解:A.盐酸是强电解质、NH3•H2O是弱电解质,pH=3的盐酸浓度小于pH=11的氨水,二者等体积混合,氨水有剩余,NH3•H2O电离程度大于NH4+水解程度,所以混合溶液呈碱性,pH>7,故A错误;
B.硝酸和氢氧化钡都是强电解质,pH=3的硝酸中c(H+)等于氢氧化钡溶液中的c(OH-),二者等体积混合,酸碱恰好反应生成强酸强碱盐,混合溶液呈中性,pH=7,故B正确;
C.硫酸是强电解质、一水合氨是弱电解质,pH=3的硫酸浓度小于pH=11的氨水,二者等体积混合,氨水有剩余,NH3•H2O电离程度大于NH4+水解程度,所以混合溶液呈碱性,pH>7,故B错误;
D.醋酸是弱电解质、氢氧化钡是强电解质,pH=3的醋酸浓度大于pH=11的氢氧化钡的浓度,而等体积混合醋酸有剩余,醋酸电离程度大于醋酸根离子水解程度,混合溶液呈酸性,pH<7,故D错误;
故选B.
点评 本题考查混合溶液定性判断,题目难度中等,明确强弱电解质电离特点、混合溶液中溶质及其性质是解本题关键,注意AC中NH3•H2O电离程度与NH4+水解程度相对大小,从而确定混合溶液酸碱性.


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:选择题
| A. | X与Y形成的化合物既能与盐酸反应也能与氢氧化钠反应 | |
| B. | X的原子半径大于Z的原子半径 | |
| C. | X与Z形成的化合物的水溶液中逐滴滴加氨水至过量,先产生白色沉淀后沉淀溶解 | |
| D. | Z的最高价氧化物对应的水化物为强酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
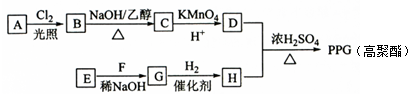

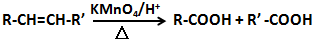
 .
.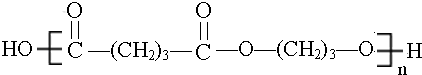 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高温度可使该反应的逆反应速率降低 | |
| B. | 反应达平衡后,CO的反应速率保持不变 | |
| C. | 使用高效催化剂可有效提高正、逆反应速率 | |
| D. | 单位时间内消耗CO和N2的物质的量之比为2:1时,反应达到平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ①② | C. | ②③ | D. | 全部正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 把CaO放入水中:CaO═Ca2++O2- | |
| B. | 加热NaHSO4至熔化:NaHSO4═Na++H++SO42- | |
| C. | 把Al2(SO4)3放入水中:Al2(SO4)3═Al3++SO42- | |
| D. | 把NaCl放入水中:NaCl═Na++Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
; .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气与烧碱溶液反应:Cl2+2OH-═Cl-+ClO-+H2O | |
| B. | 在NaOH溶液中滴入几滴NH4Cl溶液:NH4++OH-═NH3•H2O | |
| C. | 将少量铜屑放入浓硝酸中:Cu+4H++2NO3-═Cu2++2NO2↑+2H2O | |
| D. | 将稀硫酸滴在铜片上:Cu+2H+═Cu2++H2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com