
能用金属代替盐桥吗?
 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:
已知在碱存在下,卤代烃与醇反应生成醚(R—O—R’):
R-X+R’OH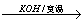 R-O-R’+HX
R-O-R’+HX
则BrCH2CH2CH2OH可发生的反应有:①氧化反应;②还原反应;③加成反应;
④在强酸强碱条件下均可发生消去反应;⑤可发生聚合反应生成高分子化合物,
其中正确的组合是
A.①②③ B.①④ C.①④⑤ D.②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
要提纯下列物质(括号内物质为杂质),实验操作最合理的是( )
A.Cl2(SO2):通入盛有品红溶液的洗气瓶
B.己烷(己烯):加入足量的溴水,充分振荡,静置分层后分离
C.硫酸铁溶液(硫酸亚铁):通入足量氯气,充分反应后加热,使多余氯气逸出
D.Mg(OH)2[Ca(OH)2]:放入水中调成浆状后,加入足量MgCl2溶液,充分搅拌,过滤,沉淀用蒸馏水洗涤
查看答案和解析>>
科目:高中化学 来源: 题型:
Li-SOCl2电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解液是LiAlCl4SOCl2。电池的总反应可表示为4Li+2SOCl2===4LiCl+S+SO2↑。
请回答下列问题:
(1)电池的负极材料为__________,发生的电极反应为_______________________。
(2)电池正极发生的电极反应为_____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下图Ⅰ、Ⅱ分别是甲、乙两组同学将反应“AsO +2I-+2H+??AsO
+2I-+2H+??AsO +I2+H2O”设计成的原电池装置,其中C1、C2均为碳棒。甲组向图Ⅰ烧杯中逐滴加入适量浓盐酸;乙组向图ⅡB烧杯中逐滴加入适量40% NaOH溶液。
+I2+H2O”设计成的原电池装置,其中C1、C2均为碳棒。甲组向图Ⅰ烧杯中逐滴加入适量浓盐酸;乙组向图ⅡB烧杯中逐滴加入适量40% NaOH溶液。
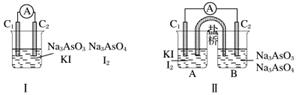
下列叙述中正确的是( )
A.甲组操作时,电流表(A)指针不发生偏转
B.甲组操作时,溶液颜色变浅
C.乙组操作时,C2作正极
D.乙组操作时,C1上发生的电极反应为I2+2e-===2I-
查看答案和解析>>
科目:高中化学 来源: 题型:
下图是在航天用高压氢镍电池基础上发展起来的一种金属氢化物镍电池(MH—Ni电池)。下列有关说法不正确的是( )
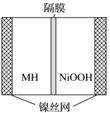
A.放电时正极反应为NiOOH+H2O+e-—→Ni(OH)2+OH-
B.电池的电解液可为KOH溶液
C.充电时负极反应为MH+OH-—→H2O+M+e-
D.MH是一类储氢材料,其氢密度越大,电池的能量密度越高
查看答案和解析>>
科目:高中化学 来源: 题型:
全钒液流电池是一种活性物质呈循环流动液态的电池,目前钒电池技术已经趋近成熟。下图是钒电池基本工作原理示意图:
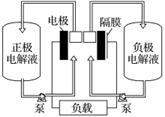
请回答下列问题:
(1)硫酸在电池技术和实验室中具有广泛的应用,在传统的铜锌原电池中,硫酸是____________,实验室中配制硫酸亚铁时需要加入少量硫酸,硫酸的作用是____。
(2)钒电池是以溶解于一定浓度硫酸溶液中的不同价态的钒离子(V2+、V3+、VO2+、VO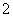 )为正极和负极电极反应的活性物质,电池总反应为VO2++V3++H2O
)为正极和负极电极反应的活性物质,电池总反应为VO2++V3++H2O V2++VO
V2++VO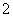 +2H+。放电时的正极反应式为______________________________________________________,充电时的阴极反应式为______________________________________。放电过程中,电解液的pH________(填“升高”、“降低”或“不变”)。
+2H+。放电时的正极反应式为______________________________________________________,充电时的阴极反应式为______________________________________。放电过程中,电解液的pH________(填“升高”、“降低”或“不变”)。
(3)钒电池基本工作原理示意图中“正极电解液”可能是________(填字母)。
a.VO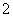 、VO2+混合液 b.V3+、V2+混合液
、VO2+混合液 b.V3+、V2+混合液
c.VO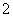 溶液 d.VO2+溶液
溶液 d.VO2+溶液
e.V3+溶液 f.V2+溶液
(4)能够通过钒电池基本工作原理示意图中“隔膜”的离子是_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D、E是原子序数由小到大排列的五种短周期元素,其中B、C、D的原子序数之和为31,A是元素周期表中原子半径最小的元素,B、C左右相邻,C、D位于同主族.
(1)E元素原子的结构示意图为: ,写出一个能证明D、E两元素非金属性强弱的反应方程式: .
(2)用电子式表示A与B形成含10个电子的分子的过程 ,其中含有的化学键为 (填“极性键”“非极性键”“离子键”).
(3)A、B、C、D四种元素中的三种能组成一种强酸,该强酸的稀溶液能与铜反应,其中起酸性作用的酸占消耗酸总物质的量的百分比是 .
(4)由A、B、C、D四种元素组成的一种离子化合物X.
①已知1mol X能与足量NaOH浓溶液反应生成标准状况下44.8L气体.写出加热条件下X与NaOH浓溶液反应的离子方程式: .
②又知X既能与E和A形成的化合物反应,又能与E形成的单质的水溶液起反应,写出X的化学式: .
(5)A、B、C、D和Fe五种元素组成相对分子质量为392的化合物Y,1mol Y中含有6mol结晶水.对化合物Y进行如下实验:
a.取Y的 溶液加入过量浓NaOH溶液并加热,产生白色沉淀和无色有刺激性气味的气体.过一段时间白色沉淀变为灰绿色,最终变为红褐色.
b.另取Y的溶液,加入过量BaCl2溶液产生白色沉淀,加盐酸沉淀不溶解.
①Y的化学式为 .
②写出Y与足量Ba(OH)2溶液反应的离子方程式: .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com