
分析 (1)Na2S2O3溶液是强碱弱酸盐,水解溶液显碱性,所以标准Na2S2O3溶液应装入碱式滴定管中;
(2)由于碘离子具有还原性,而空气中含有氧气,氧气能氧化碘离子;
(3)由于碘遇淀粉显蓝色,所以滴定时向待测液中加入的指示剂是淀粉;到达滴定终点时的现象为溶液恰好由蓝色变成无色,且半分钟内不褪色;
(4)根据1号瓶消耗的 Na2S2O3溶液,结合方程式计算20ml溶液中I2和I3-的总物质的量;根据2号瓶消耗的 Na2S2O3溶液,结合方程式计算20ml溶液中I2的物质的量,进而计算I3-的物质的量,根据c=$\frac{n}{V}$计算;
(5)取上层清液时不小心吸入了少量的I2固体,则1号瓶消耗Na2S2O3溶液的体积增加,结合(4)中c(I3-)表达式判断.
解答 解:(1)Na2S2O3溶液是强碱弱酸盐,水解溶液显碱性,所以标准Na2S2O3溶液应装入碱式滴定管中,
故答案为:碱式滴定管;Na2S2O3溶液是强碱弱酸盐,水解溶液显碱性;
(2)由于碘离子具有还原性,而空气中含有氧气,氧气能氧化碘离子,所以碘量瓶在震荡静置时要塞紧塞子的原因是防止I-被空气中的氧气氧化,
故答案为:防止I-被空气中的氧气氧化;
(3)由于碘遇淀粉显蓝色,所以滴定时向待测液中加入的指示剂是淀粉,到达滴定终点时的现象为溶液恰好由蓝色变成无色,且半分钟内不褪色,
故答案为:淀粉;溶液恰好由蓝色变成无色,且半分钟内不褪色;
(4)1号瓶消耗V1mL Na2S2O3溶液,由2Na2S2O3+I2=2NaI+Na2S4O6可知,20ml溶液中I2和I3-的总物质的量=$\frac{1}{2}$×V1×10-3L×c mol/L=0.5cV1×10-3 mol;
2号瓶消耗V2mL Na2S2O3溶液,可知20mL溶液中I2的物质的量=$\frac{1}{2}$×V2×10-3L×c mol/L=0.5cV2×10-3 mol,
故c(I3-)=$\frac{0.5c{V}_{1}×1{0}^{-3}mol-0.5c{V}_{2}×10{\;}^{-3m}ol}{20×1{0}^{-3}mol}$=${\frac{c{V}_{1}-c{V}_{2}}{40}}_{\;}$mol/L,
故答案为:${\frac{c{V}_{1}-c{V}_{2}}{40}}_{\;}$;
(5)取上层清液时不小心吸入了少量的I2固体,则1号瓶消耗Na2S2O3溶液的体积增加,由c(I3-)=${\frac{c{V}_{1}-c{V}_{2}}{40}}_{\;}$mol/L,可知,测定结果偏大,
故答案为:偏大.
点评 本题本题以碘化钾溶液中碘离子浓度的测定的有关实验探究为载体,考查氧化还原滴定、化学计算、碘元素单质及化合物的性质等,根据步骤理解测定原理是解题的关键,是对学生综合能力的考查,难度较大.


 目标测试系列答案
目标测试系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 、
、 、
、 ;比烃A少2个碳原子的同系物有4种同分异构体.
;比烃A少2个碳原子的同系物有4种同分异构体.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
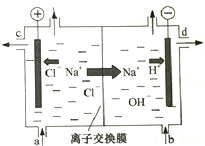 如图是离子交换膜法电解食盐水的示意图,离子交换膜只允许阳离子通过,上述精盐水需耍进行二次精制后才能作为离子交换膜电解槽的原料.对盐水进行二次精制的目的是 ( )(选填编号)
如图是离子交换膜法电解食盐水的示意图,离子交换膜只允许阳离子通过,上述精盐水需耍进行二次精制后才能作为离子交换膜电解槽的原料.对盐水进行二次精制的目的是 ( )(选填编号)| A. | 进一步降低Ca2+,Mg2+的浓度,提高烧碱纯度 | |
| B. | 进一步降低SO42-的浓度,提高烧碱纯度 | |
| C. | 防止杂质离子与碱生成的沉淀堵塞离子交换膜 | |
| D. | 防止溶液酸性或碱性过强,腐蚀离子交换膜 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 元素符号 | Li | Be | B | C | O | F | Na | Al | Si | P | S | Cl |
| 电负性 | 1.0 | 1.5 | 2.0 | 2.5 | 3.5 | 4.0 | 0.9 | 1.5 | 1.8 | 2.1 | 2.5 | 3.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4Cl 固体和Ba(OH)2晶体在常温下混合即可反应,是因为该反应是放热反应 | |
| B. | CO(g)的燃烧热是283.0kJ/mol,则2CO2(g)=2CO(g)+O2(g)的反应热为△H=+566.0kJ/mol | |
| C. | 含1mol Ba(OH)2的溶液和含1molH2SO4的溶液反应放出的热量是中和热 | |
| D. | 1mol CH4燃烧生成水蒸气和二氧化碳所放出的热量是甲烷的燃烧热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属性:K>Na>Li | B. | 热稳定性:HI>HCl>HF | ||
| C. | 非金属性:F>O>N | D. | 碱性:NaOH>Mg(OH)2>Al(OH)3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com