
加入适量KSCN溶液后,变成血红色的是
A.AlCl3溶液 B.FeCl3溶液 C.NaCl溶液 D. Cu(NO3)2溶液
 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案科目:高中化学 来源: 题型:
有机物的结构简式如下图:则此有机物可发生的反应类型有( )
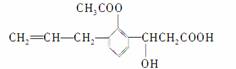
①取代 ②加成 ③消去 ④酯化 ⑤水解 ⑥氧化 ⑦中和
A.①②③⑤⑥ B.②③④⑤⑥
C.①②③④⑤⑥⑦ D.②③④⑤⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
向100mL的FeBr2溶液中,通入标准状况下Cl2 5.04L,Cl2全部被还原,测得溶液中c(Br-)=c(Cl-),则原FeBr2溶液的物质的量浓度是
A.0.75mol/L B.1.5mol/L C.2mol/L D.3mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【奥运会会标是五环旗,假定奥运五环旗中的一环表示一种物质,相 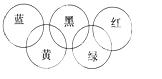
连环物质间一定条件下能发生常见反应,不相连环物质间不能发生 反应,且四种反应中必须包含化合反应、置换反应及复分解反应, 适合的一组是( )
| 蓝 | 黄 | 黑 | 绿 | 红 | |
| A | SiO2 | NaOH溶液 | CuSO4溶液 | Ag | O2 |
| B | O2 | Fe | 稀H2SO4 | NaOH溶液 | CO2 |
| C | O2 | NH3 | 稀H2SO4 | NaOH溶液 | Al(OH)3 |
| D | Mg | Al | CO2 | Fe2O3 | KOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
有关Fe及其化合物的部分转化关系如图所示。下列说法不正确的是
A.①中硫酸的浓度可以为98% B.②中试剂可以是氨水或NaOH溶液
C.③中操作为蒸发浓缩、冷却结晶 D.X一定含有SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
在FeCl3溶液蚀刻铜箔制造电路板的工艺中,废液处理和资源回收的过程简述如下:
Ⅰ:向废液中投入过量铁屑,充分反应后分离出固体和滤液;
Ⅱ:向滤液中加入一定量石灰水,调节溶液pH,同时鼓入足量的空气。
已知:Ksp[Fe(OH)3]=4.0×10-38
回答下列问题:
(1)FeCl3蚀刻铜箔反应的离子方程式为 ;
(2)过程Ⅰ加入铁屑的主要作用是 ,分离得到固体的主要成分是 ,从固体中分离出铜需采用的方法是 ;
(3)过程Ⅱ中发生反应的化学方程式为 ;
;
(4)过程Ⅱ中调节溶液的pH为5,金属离子浓度为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
某溶液可能含有Cl-、SO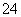 、CO
、CO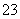 、NH
、NH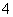 、Fe3+、Al3+和K+。取该溶液 100 mL,加入过量NaOH溶液,加热,得到0.02 mol气体,同时产生红褐色沉淀;过滤,洗涤,灼烧,得到1.6 g固体;向上述滤液中加足量BaCl2溶液,得到4.66 g不溶于盐酸的沉淀。由此可知原溶液中
、Fe3+、Al3+和K+。取该溶液 100 mL,加入过量NaOH溶液,加热,得到0.02 mol气体,同时产生红褐色沉淀;过滤,洗涤,灼烧,得到1.6 g固体;向上述滤液中加足量BaCl2溶液,得到4.66 g不溶于盐酸的沉淀。由此可知原溶液中
A、至少存在5种离子 B、Cl-一定存在,且c(Cl-)≥0.4 mol·L-1
C、SO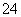 、NH
、NH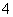 一定存在,Cl-可能不存在 D、CO
一定存在,Cl-可能不存在 D、CO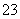 、Al3+一定不存在,K+可能存在
、Al3+一定不存在,K+可能存在
查看答案和解析>>
科目:高中化学 来源: 题型:
向Ba(OH)2溶液中逐滴加入稀硫酸.请完成下列问题:
(1)写出反应的离子方程式___________________________
(2)下列三种情况下,离子方程式与(1)相同的是________(填序号).
A.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至溶液显中性
B.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至SO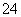 恰好完全沉淀
恰好完全沉淀
C.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至过量
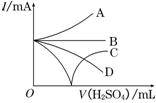
(3)若缓缓加入稀H2SO4直至过量,整个过程中混合溶液中的导电能力(用电流强度I表示)可近似地用右图中的曲线表示是________(填序号).
(4)若向装有Ba(OH)2溶液烧杯里缓缓滴入KAl(SO4)2溶液至Ba2+恰好完全反应.则反应的离子方程式是 _________________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
二草酸合铜(Ⅱ)酸钾晶体{K2[Cu(C2O4)2]·2H2O}制备流程如下:
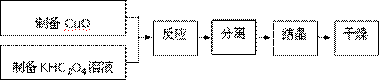
(1)制备CuO:CuSO4溶液中滴入NaOH溶液,加热煮沸、冷却、双层滤纸过滤、洗涤。
①过滤所需的玻璃仪器有
②用蒸馏水洗涤氧化铜时,如何证明氧化铜已洗涤干净
(2)①为提高CuO的利用率,让滤纸上的CuO充分转移到热的KHC2O4溶液中,以下方案正确的是
a.剪碎滤纸,加入到热的KHC2O4溶液中,待充分反应后趁热过滤
b.用稀硫酸溶解滤纸上的氧化铜,然后将溶液转入热的KHC2O4溶液中
c.用氢氧化钾溶液溶解氧化铜,并转入热的KHC2O4溶液中
d.在空气中灼烧滤纸,将剩余的固体转入热的KHC2O4溶液
②50℃水浴加热至反应充分,发生反应的化学方程式为 ;再经趁热过滤、沸水洗涤、将滤液蒸发浓缩得到二草酸合铜(Ⅱ)酸钾晶体。
(3)本实验用K2CO3粉末与草酸溶液反应制备KHC2O4,此反应进行的主要原因是 。
(4)二草酸合铜(Ⅱ)酸钾晶体的制备也可以用CuSO4晶体和K2C2O4溶液反应得到。从硫酸铜溶液中获得硫酸铜晶体的实验步骤为:加入适量乙醇、蒸发浓缩、冷却结晶、过滤、洗涤、干燥。
①加入适量乙醇的优点有:
a.缩短加热的时间,降低能耗; b. 。
②在蒸发浓缩的初始阶段还采用了蒸馏的操作,其目的是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com