
【题目】I.氢能的存储是氢能应用的主要瓶颈,配位氢化物、富氢载体化合韧是目前所采用的主要储氢材料。
(1)Ti(BH4)2是一种过渡元素硼氢化物储氢材料。在基态Ti2+中,电子占据的最高能层符号为_______,该能层具有的原子轨道数为_____;
(2)液氨是富氢物质,是氢能的理想载体,利用![]() 实现储氢和输氢。下列说法正确的是________;
实现储氢和输氢。下列说法正确的是________;
a.NH3分子中氮原子的轨道杂化方式为sp2杂化
b.NH4+与PH4+、CH4、BH4-、ClO4-互为等电子体
c.相同压强时,NH3的沸点比PH3的沸点高
d.[Cu(NH3)4]2+离子中,N原子是配位原子
(3)已知NF3与NH3的空间构型相同,但NF3不易与Cu2+形成配离子,其原因是________;
II.氯化钠是生活中的常用调味品,也是结构化学中研究离子晶体时常用的代表物,其晶胞结构如图所示。
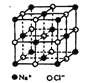
(1)设氯化钠晶体中Na+与跟它最近邻的Cl-之间的距离为r,则该Na+与跟它次近邻的C1-个数为______,该Na+与跟它次近邻的Cl—之间的距离为_____;
(2)已知在氯化钠晶体中Na+的半径为以a pm,Cl-的半径为b pm,它们在晶
体中是紧密接触的,则在氯化钠晶体中离子的空间利用率为_____;(用含a、b的式子袁示)
(3)纳米材料的表面原子占总原子数的比例很大,这是它有许多特殊性质的原因。假设某氯化钠颗粒形状为立方体,边长为氯化钠晶胞的10倍,则该氯化钠颗粒中表面原子占总原子数的百分比为________________。
【答案】M 9 cd N、F、H三种元素的电负性为F> N>H,在NF3中,共用电子对偏向F,偏离N原子,使得氮原子上的孤电子对难于与Cu2+形成配位键 8 ![]() r
r 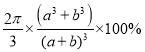 26% 或
26% 或![]()
【解析】
Ⅰ.(1)Ti原子核外有22个电子,其基态原子的核外电子排布式为1s22s22p63s23p63d24s2,在基态Ti2+中,核外电子排布式为1s22s22p63s23p63d2,对应能层分别为K、L、M,其中能量最高的是最外层M层,该能层有s、p、d三个能级,s能级有1个轨道,p能级有3个轨道,d能级有5个轨道,所以共有9个原子轨道。
(2)a.NH3分子中N原子含有3个共用电子对和一个孤电子对,所以其价层电子对是4,采用sp3杂化,故错误。
b.等电子体是指具有相同的价电子数目和原子数目的分子或离子,NH4+与BH4-、ClO4-原子数目相同,但是其价电子数目不同,所以不是等电子体,故错误。
c.相同压强时,氨气分子间存在氢键,PH3分子间不存在氢键,所以NH3沸点比PH3高,故正确;
d..[Cu(NH3)4]2+离子中,N原子提供孤电子对,所以N原子是配位原子,故正确。
所以选cd 。
(3)N、F、H三种元素的电负性:F>N>H,所以NH3中共用电子对偏向N,而在NF3中,共用电子对偏向F,偏离N原子,故答案为:F的电负性比N大,N-F成键电子对向F偏移,导致NF3中N原子核对其孤对电子的吸引能力增强,难以形成配位键,故NF3不易与Cu2+形成配离子(或者N、F、H三种元素的电负性:F>N>H,在NF3中,共用电子对偏向F,偏离N原子使得氮原子上的孤对电子难于与Cu2+形成配位键.);
Ⅱ.(1)氯化钠晶体中,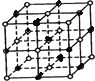 ,从图中可以看出,钠离子在体心和棱心位置,氯离子在顶点和面心位置,Na+与跟它最近邻的C1-(也就是图中晶胞大立方体中的8个顶点小白圈 )个数为8个,该Na+与跟它最近邻的Cl-之间的距离也就是边长为r的小立方体的体对角线,也就是
,从图中可以看出,钠离子在体心和棱心位置,氯离子在顶点和面心位置,Na+与跟它最近邻的C1-(也就是图中晶胞大立方体中的8个顶点小白圈 )个数为8个,该Na+与跟它最近邻的Cl-之间的距离也就是边长为r的小立方体的体对角线,也就是![]() r 。
r 。
(2)晶胞为面心立方,一个氯化钠晶胞中有4个Na+和Cl-,这个正方体的边长是2(a+b)pm,体积是8(a+b)3pm3,一个Na+体积是![]() pm3,一个Cl-体积是
pm3,一个Cl-体积是![]() pm3,4个Na+和Cl-体积是
pm3,4个Na+和Cl-体积是![]() pm3,氯化钠晶体中离子的空间利用率为
pm3,氯化钠晶体中离子的空间利用率为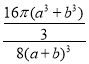 ×100%=
×100%=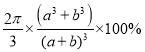 。
。
(3)由NaCl的晶胞图可知,NaCl的晶胞为正立方体结构,立方体的体心只有一个Na+,而其它的离子都处在立方体的面上,边长为氯化钠晶胞边长的10倍的氯化钠颗粒中总原子数为21的立方,而其内部的总原子数为19的立方(立方体相对的两个面上各被剥去了一层原子,所以整个边长相当于是减少了2,所以是19),所以该氯化钠颗粒中表面原子占总原子数的百分比为![]() =26%,另外列一种比较直观明了的解法: 由于立方体中的总原子数为n3(n为棱上原子数) 因此边长为氯化钠晶胞边长的10倍的氯化钠颗粒中总原子数为213,而其内部的总原子数为193(相当于将外面剥掉一层),所以其表面的原子数为213-193。表面原子占总原子数的百分数:
=26%,另外列一种比较直观明了的解法: 由于立方体中的总原子数为n3(n为棱上原子数) 因此边长为氯化钠晶胞边长的10倍的氯化钠颗粒中总原子数为213,而其内部的总原子数为193(相当于将外面剥掉一层),所以其表面的原子数为213-193。表面原子占总原子数的百分数: ![]() =26%。
=26%。


 巧学巧练系列答案
巧学巧练系列答案科目:高中化学 来源: 题型:
【题目】我国是干电池的生产和消费大国。某工厂用软锰矿(主要成分是MnO2,含少量Al2O3和SiO2)和闪锌矿(主要成分是ZnS,含少量FeS、CuS等杂质)为原料制备MnO2和Zn(干电池原料),其简化流程如下:

已知:经过反应Ⅰ后,所有金属元素均以离子形式存在。
回答下列问题:
(1)碱性锌锰干电池是以锌粉为负极,二氧化锰为正极,氢氧化钾溶液为电解质。电池总反应为2MnO2+Zn+2KOH=2MnOOH+K2ZnO2,请写出电池的正极反应式__________。
(2)滤渣1中除了SiO2以外,还有一种淡黄色物质,该物质是由MnO2、CuS与硫酸共热时产生的,请写出该反应化学方程式________________。
(3)反应Ⅱ中加入适量金属锌的目的是为了回收某种金属,请写出该反应的离子方程式______。
(4)反应Ⅲ中X可以是______。(填字母代号)
a.MgO b.Zn(OH)2 c.Cu2(OH)2CO3 d.MnCO3
(5)已知:H2S的电离常数K1=1.0×107,K2=7.0×1015。0.1 mol/L NaHS的pH___7(填“>”“=”或“<”)。
(6)在废水处理领域中常用H2S将Mn2+转化为MnS除去,向含有0.020 mol·L1 Mn2+废水中通入一定量的H2S气体,调节溶液的pH=a,当HS浓度为1.0×104 mol·L1时,Mn2+开始沉淀,则a=________。[已知:Ksp(MnS)=1.4×1015]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电化学知识在物质制备领域的应用前景看好。

(1)从环境保护的角度看,制备一种新型多功能水处理剂 高铁酸钠(Na2FeO4)较好的方法为电解法,其装置如图①所示:
①电解过程中阳极的电极反应式为______________________;
②“镁一次氯酸盐”燃料电池可为图①装置提供电能,该电池电极为镁合金和铂合金,其工作原理如图②所示。b为该燃料电池的___________(填“正"或“负")极。当有16.6 g Na2FeO4生成时消耗C1O-的物质的量为______mol;
(2)电解Na2SO4溶液生产H2SO4和烧碱的装置如图③所示(已知:阳离子交换膜只允许阳离子通过,阴离子交换膜只允许阴离子通过),其中阴极和阳极均为惰性电极。测得同温同压下,气体甲与气体乙的体积比约为1:2。则丁为_________;电解一段时间,当产生0.1 mo1气体甲时,通过离子交换膜f的离子的质量为_____________g。
(3)用0.1032 mol/L的NaOH溶液滴定未知浓度的稀盐酸,实验数据如下表:
实验序号 | 消耗NaOH溶液的体积/mL | 待测稀盐酸的体积/mL |
1 | 28.84 | 25.00 |
2 | 27.83 | 25.00 |
3 | 27.85 | 25.00 |
根据表格计算c(HCl)=______________。在上述滴定过程中,若滴定前碱式滴定管下端尖嘴中无气泡,滴定后有气泡,则测定结果将__________ (填“偏大”、“偏小”或“不影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,VIA元素单质与H2反应生成气态H2X的热化学方程式如下:
1/2O2(g) + H2(g) =H2O(g) ΔH = -242 kJ·mol-1
S(g) + H2(g) =H2S(g) ΔH = -20 kJ·mol-1
Se(g) + H2(g)![]() H2Se(g) ΔH = +81 kJ·mol-1
H2Se(g) ΔH = +81 kJ·mol-1
下列说法正确的是( )
A. 稳定性:H2O > H2S > H2Se
B. 降温有利于Se与H2反应生成H2Se
C. O2(g) + 2H2S(g)=2H2O(g) + 2S(g) ΔH = 444 kJ·mol-1
D. 随着核电荷数的增加,VIA族元素单质与H2的化合反应越容易发生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿(主要成分为FeTiO3,还含有少量MgO、SiO2等杂质)来制备,工艺流程如下:

回答下列问题:
(1)“酸浸”实验中,铁的浸出率结果如下图所示。由图可知,当铁的净出率为70%时,所采用的实验条件为___________________。

(2)“酸浸”后,钛主要以TiOCl42-形式存在,写出相应反应的离子方程式__________________。
(3)TiO2·xH2O沉淀与双氧水、氨水反应40 min所得实验结果如下表所示:
温度/℃ | 30 | 35 | 40 | 45 | 50 |
TiO2·xH2O转化率% | 92 | 95 | 97 | 93 | 88 |
分析40℃时TiO2·xH2O转化率最高的原因__________________。
(4)Li2Ti5O15中Ti的化合价为+4,其中过氧键的数目为__________________。
(5)若“滤液②”中c(Mg2+)=0.02 mol/L,加入双氧水和磷酸(设溶液体积增加1倍),使Fe3+恰好沉淀完全即溶液中c(Fe3+)=1×10-5 mol/L,此时是否有Mg3(PO4)2沉淀生成?___________(列式计算)。
FePO4、Mg3(PO4)2的Ksp分别为1.3×10-22、1.0×10-24。
(6)写出“高温煅烧②”中由FePO4制备LiFePO4的化学方程式______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学实验的微型化可有效地减少污染,实现化学实验绿色化的要求。某学生按下列操作做一个实验:在一块下衬白纸的玻璃片的不同位置分别滴加浓度为0.1 mol/L的KBr、KI(含淀粉溶液)、NaOH(含酚酞)、FeCl2(含KSCN)溶液各1滴,每种液滴彼此分开,围成半径小于表面皿的圆形(如下图所示),在圆心处放置2粒芝麻粒大小的KMnO4晶体,向KMnO4晶体滴加一滴浓盐酸,再立即用表面皿盖好。(已知2KMnO4+16HCl(浓)![]() 2KCl+2MnCl2+5Cl2↑+8H2O)
2KCl+2MnCl2+5Cl2↑+8H2O)

(1)e处反应的离子方程式为_________________________________________。该反应中氧化剂和还原剂的物质的量之比为_______________________。
(2) d处的实验现象:__________________________________________。
(3)c处反应的化学方程式为_________________________________。标准状况下,当有0.224 L Cl2被NaOH溶液吸收后,转移电子的物质的量为__________mol。
(4)通过该实验能否比较Cl2、FeCl3、KMnO4三种物质氧化性的强弱?__________(填“能”或“不能” ),若能,其氧化性由强到弱的顺序是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E为原子序数依次增大的短周期元素,已知A、B、E 3种原子最外层共有11个电子,且这3种元素的最高价氧化物的水化物两两皆能发生反应生成盐和水,C元素的最外层电子数比次外层电子数少4,D元素原子次外层电子数比最外层电子数多3。
(1)写出下列元素符号:A _______ ,B________,C________,D________,E__________
(2)A与E两元素可形成化合物,用电子式表示其化合物的形成过程:____________ 。
(3)写出A、B两元素最高价氧化物的水化物相互反应的化学方程式:______________ 。
(4)比较C、D的最高价氧化物的水化物的酸性:(用化学式表示)_______________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁电池是一种新型可充电电池,与普通高能电池相比,该电池长时间保持稳定的放电电压。高铁电池的总反应为:3Zn+2K2FeO4+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是
3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是
A. 放电时负极反应为:Zn-2e-+2OH-=Zn(OH)2
B. 充电时阳极反应为:Fe(OH)3-3e-+5OH-=![]() +4H2O
+4H2O
C. 放电时每转移3 mol电子,正极有1 mol K2FeO4被氧化
D. 放电时正极附近溶液的碱性增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)泡沫灭火器的灭火原理是(用离子方程式表示)_____________________。
(2)①已知T℃时,Kw=1×10-12,在该温度时,将pH=9的NaOH溶液aL与pH=2的H2SO4溶液bL混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=3,则a:b=____。
②某二元酸(用H2A表示)在水中的电离方程式是:H2A=H++HA-,HA- ![]() H++A2-,则NaHA溶液中,写出符合原子(物料)守恒的各粒子浓度关系的等式_____________
H++A2-,则NaHA溶液中,写出符合原子(物料)守恒的各粒子浓度关系的等式_____________
(3)pH=2的两种一元酸HA和HB,体积均为100 mL,稀释过程中pH与溶液体积的关系如图。
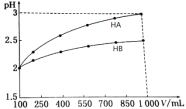
①则NaB水溶液是否呈中性?原因?______________(用离子方程式表示)。
②用NaOH溶液滴定HB溶液,指示剂宜选择_________,滴定终点现象为____________。
A.甲基橙 B.酚酞 C.石蕊
(4)NaHSO3溶液呈酸性,则溶液中,各离子浓度由大到小的顺序为____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com