
分析 纯水中氢离子浓度等于氢氧根离子浓度,温度不变水的离子积不变,根据水的离子积计算酸溶液中氢氧根离子浓度,酸性溶液氢氧根离子只能由水电离,水电离出氢离子浓度等于氢氧根离子浓度,PH=-lgC(H+),氢离子浓度越大,PH越小,水的电离吸热,温度越高,KW越大.
解答 解:某温度t时,测得纯水中c(H+)=2×10-7mol/L,纯水中一定满足c(OH-)=c(H+),所以此时c(OH-)=c(H+)=2×10-7mol/L,水的离子积为:KW=c(OH-)×c(H+)=2.0×10-7×2.0×10-7=4.0×10-14,若t不变,滴入稀硫酸c(H+)=5×10-6 mol/L,溶液中氢离子浓度c(H+)=5.0×10-6mol/L,c(OH-)=$\frac{4.0×1{0}^{-14}}{5.0×1{0}^{-6}}$=8.0×10-9mol/L,酸性溶液氢氧根离子只能由水电离,水电离出氢离子浓度等于氢氧根离子浓度,所以此时溶液中由水电离产生的c(H+)=8×10-9mol/L;由于纯水中c(H+)=2×10-7mol/L>1×10-7mol/L,故此时pH<7,25℃,KW=1.0×10-14,水的电离吸热,温度越高,KW越大,某温度t时,KW=4.0×10-14>1.0×10-14,温度t>25℃,
故答案为:2×10-7mol/L;8.0×10-9mol/L;8×10-9mol/L;<;>.
点评 本题考查了弱电解质的电离,注意水的离子积常数只与温度有关,与溶液的酸碱性无关,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 只要用燃烧的方法就可以鉴别氢气和甲烷 | |
| B. | 闻气味、与金属钠反应、与大理石反应、与新制氢氧化铜反应都可以鉴别酒精和醋酸 | |
| C. | 检验氯乙烷中是否含有氯原子的方法是:氯乙烷与氢氧化钠溶液混合加热片刻后,滴加硝酸银溶液观察是否有白色沉淀 | |
| D. | 检验淀粉水解是否生成葡萄糖的方法是:在水解后的溶液中直接加入新制的氢氧化铜观察是否产生红色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 用10mL量筒量取7.13mL稀盐酸 | |
| B. | 用托盘天平称量25.20gNaCl | |
| C. | 用精密pH试纸测得某溶液的pH为2.3 | |
| D. | 中和滴定时用去某浓度的碱溶液21.70mL |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 因为铝与氢氧化钠溶液可以发生反映,故不能用氢氧化钠溶液除去铝表面的氧化膜 | |
| B. | 金属钠可与水反应,故不能用金属钠置换其他金属 | |
| C. | 锌的活动性比铁强,可在海轮外壳上镶入锌块以缓解轮船腐蚀 | |
| D. | 氧化铜是黑色固体,与水反应可生成氢氧化铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
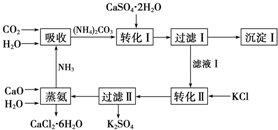
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.2 mol•L-1NaSO4,溶液中含有0.4NA个Na+ | |
| B. | 标准状况下,NA个CO2分子与NA个H2SO4分子所占的体积之比为1:1 | |
| C. | 常温常压下,64gSO2中含有的原子数为3NA | |
| D. | 1 molAl3+含有的核外电子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 时间/min | c(H2)/mol•L-1 | c(CH3OH)/mol•L-1 | v正和v逆比较 |
| t0 | 6 | 0 | ? |
| t1 | 3 | 1 | v正=v逆 |
| A. | t0~t1时间内,v(H2)=$\frac{3}{{t}_{1}-{t}_{0}}$ mol•L-1•min-1 | |
| B. | T℃时,该反应的平衡常数K=$\frac{1}{27}$,CO2与H2的转化率不相等 | |
| C. | t0时,v正>v逆 | |
| D. | t1时,若升高温度或再充入CO2气体,都可以提高H2的转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纤维素、蛋白质、油脂都是高分子化合物 | |
| B. | 糖类、蛋白质、油脂都是由C、H、O三种元素组成的 | |
| C. | 油脂有油和脂肪之分,但都属于酯 | |
| D. | 所有的糖类物质都可以发生水解反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com