
奥运吉祥物福娃外材为纯羊毛线,内充物为无毒的聚酯纤维(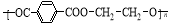 ),下列说法不正确的是
),下列说法不正确的是
A.可用点燃方法区别羊毛与聚酯纤维
B.聚酯纤维和羊毛一定条件下均能水解
C.该聚酯纤维单体为对苯二甲酸和乙二醇
D.由单体合成聚酯纤维的反应属加聚反应
 寒假学与练系列答案
寒假学与练系列答案科目:高中化学 来源:2015届河南省洛阳市高二上学期期末检测化学试卷(A)(解析版) 题型:填空题
碳、氮和铝的单质及其化合物在工农业生产和生活中有重要的作用。
(1)真空碳热还原—氯化法可实现由铝矿制备金属铝,其相关的热化学方程式如下:
①2Al2O3(s)+2AlCl3(g)+6C(s) = 6AlCl(g)+6CO(g) ΔH=a kJ·mol-1
②3AlCl(g) = 2Al(l)+AlCl3(g) ΔH=b kJ·mol-1
反应:Al2O3(s)+3C(s)=2Al(l)+3CO(g)的ΔH = kJ·mol-1 (用含a、b的代数式表示);
(2)用活性炭还原法可以处理氮氧化物。某研究小组向某密闭容器中加入一定量的活性炭和NO,发生反应C(s)+2NO(g)  N2(g)+CO2(g) ΔH =Q kJ·mol-1。在T1℃时,反应进行到不同时间测得各物质的浓度如下:
N2(g)+CO2(g) ΔH =Q kJ·mol-1。在T1℃时,反应进行到不同时间测得各物质的浓度如下:
时间/min 浓度/mol/L | 0 | 10 | 20 | 30 | 40 | 50 |
NO | 1.00 | 0.68 | 0.50 | 0.50 | 0.60 | 0.60 |
N2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
CO2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
①0~10 min内,NO的平均反应速率v(NO)= ,T1℃时,该反应的平衡常数= 。
②30 min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是 (填字母编号)。
A.通入一定量的NO B.加入一定量的活性炭
C.加入合适的催化剂 D.适当缩小容器的体积
③在恒容条件下,能判断该反应一定达到化学平衡状态的依据是 (填选项编号)。
A.单位时间内生成2 n mol NO(g)的同时消耗n mol CO2(g)
B.反应体系的温度不再发生改变
C.混合气体的密度不再发生改变
D 反应体系的压强不再发生改变
查看答案和解析>>
科目:高中化学 来源:2015届河北省邯郸市高二上学期期末考试化学试卷(解析版) 题型:选择题
下列方程式中属于水解反应的是
A.HCO3-+H2O  H3O++CO32-
H3O++CO32-
B.HCO3-+H2O  OH-+H2CO3
OH-+H2CO3
C.NH3+H2O  NH4++OH-
NH4++OH-
D.HCO3-+OH- =CO32-+H2O
查看答案和解析>>
科目:高中化学 来源:2015届河北省高二下学期第一次月考化学试卷(解析版) 题型:选择题
A、B两种有机物无论以何种比例混合,只要混合物的总质量不变,完全燃烧时生成CO2的量也不变,则对于A与B的关系,下列描述正确的是
①A、B一定互为同分异构体 ②A、B一定互为同系物 ③A、B一定具有相同的最简式
④A、B含碳质量分数相同,其中正确的是
A.①②③④ B.③④ C.②③ D.④
查看答案和解析>>
科目:高中化学 来源:2015届河北省高二下学期第一次月考化学试卷(解析版) 题型:选择题
下列有关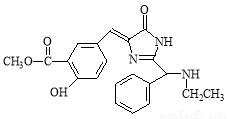 的说法中不正确的是
的说法中不正确的是
A.该有机物能发生水解反应
B.该有机物的化学式为C21H20N3O4
C.该有机物不能发生消去反应
D.该有机物既能与溴水反应,又能与碳酸钠溶液反应
查看答案和解析>>
科目:高中化学 来源:2015届江西赣州市高二上学期期末联考化学试卷(解析版) 题型:填空题
工业上采用的一种污水处理方法是:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀。Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用。某科研小组用此法处理污水,设计装置示意图,如图所示。
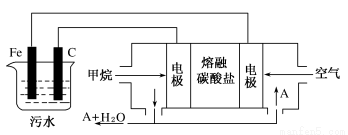
(1)实验时若污水中离子浓度较小,导电能力较差,无法使悬浮物形成浮渣。此时,应向污水中加入适量的________。
A.BaSO4 B.CH3CH2OH C.Na2SO4 D.NaOH
(2)电解池阳极发生了两个电极反应,其中一个反应生成一种无色气体,则阳极的电极反应式分别是:
①___________________________________________________;
②___________________________________________________。
(3)电极反应①和②的生成物反应得到Fe(OH)3沉淀的离子方程式是__________ ____。
(4)该燃料电池是以熔融碳酸盐为电解质,CH4为燃料,空气为氧化剂,稀土金属材料做电极。已知负极的电极反应是CH4 +4CO32--8e-=5CO2+2H2O。则正极的电极反应是 。为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,此电池工作时必须有部分A物质参加循环,则A物质的化学式是_________。
查看答案和解析>>
科目:高中化学 来源:2015届江西赣州市高二上学期期末联考化学试卷(解析版) 题型:选择题
下列有关溶液中粒子浓度的关系式中,正确的是( )

A.pH相同的①CH3COONa、②NaHCO3、③Na2CO3三份溶液中的c(Na+):③>②>①
B.0.1mol·L-1某二元弱酸强碱盐NaHA溶液中: c(Na+)=2c(A2-)+c(HA-)+c(H2A)
C.图中pH=7时:c(Na+)>c(CH3COO-) >c(OH-)=c(H+)
D.图中a点溶液中各离子浓度的关系是:c(OH-)=c(H+)+c(CH3COO-)+2c(CH3COOH)
查看答案和解析>>
科目:高中化学 来源:2015届江西省赣州市六校高二上学期期末联考化学试卷(解析版) 题型:填空题
10000C时,硫酸钠可与氢气发生反应: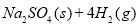

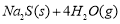 。请回答下列问题:
。请回答下列问题:
(1)上述反应的平衡常数表达式为: 。
(2)上述反应在三个不同条件下进行,其中H2的浓度随时间的变化如图所示。
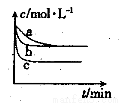
①与曲线a比较,b和c分别仅改变一种反应条件,则曲线b改变的条件为
②该反应的△H___0(填“>”、“<”或“=”),其判断理由是 。
(3)该温度下,向2L盛有1.42g Na2SO4的密闭容器中通入H2,5min后测得
固体质量为1.10g。则该时间范围内的平均反应速率v(H2)= 。
(4)能说明该反应已达到平衡状态的是 (填字母,下同)。
a.容器内压强保持不变
b.容器内气体密度保持不变
c.c(H2)=c(H2O)d.v正(H2)=v逆(H2O)
查看答案和解析>>
科目:高中化学 来源:2015届江苏省教学协作体高二上学期期末化学试卷(解析版) 题型:实验题
为了“探究铁及其化合物的氧化性或还原性”.
(1)实验前同学预测:Fe2+肯定既有还原性又有氧化性.你认为他预测的依据是:__
(2)甲同学欲用实验证明他的预测.实验室提供了下列试剂:3%的H2O2溶液、锌粒、铜片、0.1mol·L -lFeCl2溶液、KSCN溶液、新制氯水.
①若计划在0.1 mol·L-l FeCl2溶液中滴入新制氯水,探究Fe2+的还原性,你预计可能发生反应的离子方程式为
②实验中,甲同学发现现象不太明显,老师分析可能是产物的含量太低,建议可以通过检验Fe2+反应的产物的存在以获取证据.你认为可选_____滴入小明所得的混合液中,并通过溶液出现___色的现象,证明该同学的观点和实验方案都是正确的.
③对于证明Fe2+具有氧化性,该同学认为金属单质都具有还原性,并分别将铜片、锌粒投入FeCl2溶液中,结果锌粒逐渐变小.由此说明三种金属的还原性由强至弱的顺序为_____ ___.
(3)甲同学分析H2O2中氧元素显-1价(中间价),并提出疑问:H2O2与FeCl2的反应时,Fe2+还作氧化剂吗?
①请你为该同学梳理相关问题:若Fe2+在反应中表现出氧化性应转化成______(填微粒符号,下同),若Fe2+在反应中表现出还原性应转化成_____.
②实际上Fe2+还原性较强,实验室的FeCl2溶液常因氧化而变质.除杂的方法是: ,相关反应的离子方程式:_____ .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com