
【题目】元素周期表与元素周期律在学习、研究和生产实践中有重要的作用。下表列出①⑩十种元素在周期表中的位置。
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
2 | ⑤ | ⑧ | ||||||
3 | ① | ③ | ④ | ⑥ | ⑨ | |||
4 | ② | ⑦ | ⑩ |
(1)①~⑩中金属性最强的元素为____________(写名称)。
(2)①、⑧两种元素形成的化合物,在高温下灼烧,火焰呈____________色。
(3)⑦、⑨两种元素的最高价氧化物对应水化物的酸性较强的是____________(填化学式)。
(4)①、⑥、⑧、⑨四种元素形成的简单离子半径由大到小的顺序依次是____________span>。(用微粒符号来表示)
(5)⑤元素的氢化物实验室制法的化学方程式是____________。
(6)⑤、⑨的气态氢化物在空气中相遇有白烟生成,写出白烟对应物质的电子式____________。
(7)下列说法正确的是____________(填字母)。
a.⑥的非金属性强于⑦ b.氢化物稳定性:⑦<⑩ c.③单质与水反应比单质①剧烈
【答案】钾 黄 HClO4 S2->Cl->F->Na+ 2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O
CaCl2+2NH3↑+2H2O ![]() ab
ab
【解析】
依据元素在周期表中的位置,可确定①~⑩分别为Na、K、Mg、Al、N、S、Se、F、Cl、Br。利用同周期、同主族元素的性质递变规律,可比较元素的金属性、非金属性强弱,并由此判断氢化物的稳定性、最高价氧化物的水化物的酸性强弱,比较原子半径的大小顺序等。
(1)同周期元素,从右到左,金属性依次增强,同主族元素,从上到下,金属性依次增强,所以金属性最强的元素位于元素周期表的左下角,①~⑩中金属性最强的元素为②,其为钾。答案为:钾;
(2)①、⑧两种元素分别为Na、F,形成的化合物为NaF,在高温下灼烧,火焰呈黄色。答案为:黄;
(3)⑦、⑨两种元素分别为Se、Cl,非金属性Se<Cl,最高价氧化物对应水化物的酸性较强的是HClO4。答案为:HClO4;
(4)①、⑥、⑧、⑨四种元素分别为Na、S、F、Cl,形成的简单离子中,电子层数多、离子半径大,核外电子排布相同的离子,核电荷数越大离子半径越小,则半径由大到小的顺序依次是S2->Cl->F->Na+。答案为:S2->Cl->F->Na+;
(5)⑤元素为N,其氢化物在实验室用NH4Cl和Ca(OH)2加热条件下反应制得,化学方程式是2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O。答案为:2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O。答案为:2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O;
CaCl2+2NH3↑+2H2O;
(6)⑤、⑨分别为N和Cl,气态氢化物在空气中相遇有白烟生成,此白烟对应物质为NH4Cl,电子式为![]() 。答案为:
。答案为:![]() ;
;
(7)a.⑥和⑦分别为S和Se,二者为同主族元素,非金属性S强于Se,a正确;
b.⑦和⑩分别为Se和Br,二者为同周期元素,非金属性Se<Br,所以氢化物稳定性:Se<Br,b正确;
c.①和③分别为Na和Mg,二者位于同周期,金属性Na>Mg,单质与水反应Na比单质Mg剧烈,c不正确;
故选ab。答案为:ab。


科目:高中化学 来源: 题型:
【题目】李比希是 19 世纪最著名和最有成果的化学家。他的贡献之一就是发明了燃烧法测定有机物化学组成。
Ⅰ.某物质完全燃烧后生成二氧化碳和水,现取 3.0g 该物质利用李比希法进行组成测定,无水氯化钙增重 1.8g,浓氢氧化钾溶液增重 4.4g,则该物质的最简式为_________________;
Ⅱ.多种物质符合此最简式,若要确定具体的物质,还需辅助其它的测量手段。
(1)若物质 A 的质谱图如图所示:
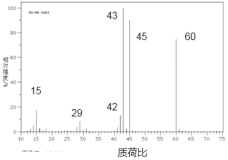
①则 A 的相对分子质量为_____________________;
②若将 A 加入到紫色石蕊试液中变红,则 A 的结构简式为________________;
(2)若测定物质 B 的蒸气密度是相同状况下 H2 的 45 倍
①则 B 的分子式为__________________;
②测定 B 的红外光谱图有 C=O 键、O—H 键、不对称—CH2—等的振动吸收峰,其核磁共振氢谱如图所示,B 的结构简式为_________________;

③取一定量的B物质平均分成2份,一份与足量的NaHCO3作用,一份与足量的Na作用,则产生的CO2与H2的体积比为___;
(3)若测定 C 物质的相对分子质量为 180,且 C 为淀粉水解的最终产物,并且在一定条件下, C 能与上述的 A 物质发生如下转化关系:

①请写出 D 变成 E 的化学方程式___________________;
②已知 G 物质为 D 物质的同系物,相对分子质量比 D 大 14,且其核磁共振H谱显示 3 组峰,面积比为 6:1:1,请写出 G 与 A 发生酯化反应的方程式____________,
Ⅲ.分别将等质量的上述A、B、C三种物质与足量的氧气反应,它们实际消耗氧气的物质的量之比为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼、铁、镍及其化合物在生产、生活中有广泛应用。请回答下列问题:
(1)基态铁原子的外围电子排布式为__________。
(2)NaBH4、LiBH4常作有机合成的还原剂。LiBH4中B原子的杂化方式为________;BH4-的空间构型为____________。
(3)NiO、FeO的晶体类型相同,已知Ni2+、Fe2+的半径分别为72 pm、76 pm。熔点:FeO_____NiO(填“>”、“<”或“=”),理由是____________。
(4)镍能形成多种配合物,如Ni(CO)4、[Ni(NH3)6]2+等。[Ni(NH3)6]2+中,Ni2+的配位数为_________;在Ni(CO)4中提供孤电子对的原子是C,不是O,可能的原因是_________。
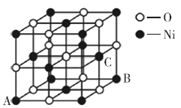
(5)氧化镍晶胞如图所示,镍离子的配位数为__________。已知晶胞参数为a cm,NA为阿伏加德罗常数的值,则氧化镍晶体密度为__________g·cm-3。
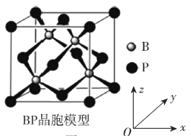
(6)磷化硼晶体结构类似金刚石,是一种耐磨材料,常作金属涂层,其晶胞如图所示。磷化硼晶胞沿z轴的平面投影图中,B原子构成的几何形状是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数,下列叙述正确的是
A.15g甲基(-CH3)中含有的电子数为9NA
B.标准状况下,2.24L辛烷中所含碳原子数为0.8NA
C.1.8gH2O与D2O的混合物中含有的质子数和电子数均为NA
D.—定条件下,密闭容器中2molSO2(g)与1molO2(g)充分反应,则容器中分子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水热法制备直径为1-100nm的颗粒Y(化合物),反应原理为3Fe2++2![]() +O2+aOH-=Y+
+O2+aOH-=Y+![]() +2H2O,下列说法中不正确的
+2H2O,下列说法中不正确的
A.a=4
B.将Y均匀分散到水中形成的体系具有丁达尔效应
C.Fe2+、![]() 都是还原剂
都是还原剂
D.每有3molFe2+参加反应,反应中转移的电子总数目为5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组为研究电化学原理,设计如图装置.下列叙述不正确的是( )

A. a和b不连接时,铁片上会有金属铜析出
B. a和b用导线连接时,铁片上发生的反应为:Fe-2e-=Fe2+
C. a和b用导线连接时电子从Cu片流向铁片
D. a和b用导线连接时,Cu2+向铜电极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道,2012年俄罗斯科学家再次合成117号元素。本次实验生成了6个新原子,其中5个![]() ,1个
,1个![]() 。下列关于
。下列关于![]() 和
和![]() 的说法不正确的是
的说法不正确的是
A. 是元素X的两种不同核素 B. 电子数相差1
C. 中子数分别为176和177 D. 它们互为同位素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某科研小组采用如下方案拆解废钴酸锂电池并从拆解的正极片中回收锂和钴,主要的实验流程如下:
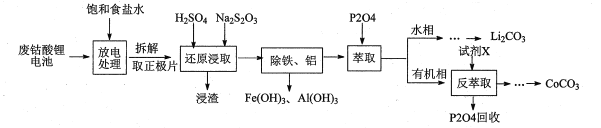
已知:①正极片中主要含LiCoO2(难溶于水)以及少量乙炔炭黑及铝箔等;负极为石墨,充电时Li+嵌入石墨电极。
②P2O4为磷酸二异辛酯,密度为0.973g.cm-3。
③3HBrO+CO(NH2)2=3HBr+N2↑+2H2O+CO2↑。
(1)“放电处理”时,有关说法正确的是__________(填标号)。
A.有利于锂的回收,提高锂的回收率
B.处理的主要目的是回收残余的电能
C.处理过程中产生的气体只有O2
D.可防止在电池拆解过程中,发生短路引起火灾、爆炸事故等安全问题
(2)“还原浸取”时,发生反应的离子方程式为_____________(S2O32-被氧化为SO42-)。
(3)“除铁、铝”时,应调整溶液的pH范围为___________(下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol·L-1计算)。

(4)“萃取”与“反萃取”时,静置后(如图所示),获得有机相的操作方法是__________;“反萃取”试剂X适宜是___________(填“H2SO4”或“NaOH”)溶液。
(5)设计以流程中产品Li2CO3为原料,制取LiBr·H2O的实验方案:向烧杯中加入适量冷水,______________,干燥得LiBr·H2O[实验中必须使用的试剂:饱和溴水、尿素及活性炭]。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)![]() CH3OH(g)。
CH3OH(g)。
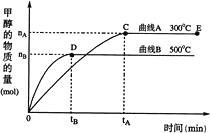
根据题意完成下列各题:
(1)反应达到平衡时,平衡常数表达式K=_______________,升高温度,K值_______(填“增大”、“减小”或“不变”)。
(2)在500℃,从反应开始到平衡,氢气的平均反应速率v(H2)=_____________。
(3)在其他条件不变的情况下,对处于E点的体系体积压缩到原来的1/2,下列有关该体系的说法正确的是_______:
a.氢气的浓度减少 b.正反应速率加快,逆反应速率也加快
c.甲醇的物质的量增加 d.重新平衡时n(H2)/n(CH3OH)增大
(4)据研究,反应过程中起催化作用的为Cu2O,反应体系中含少量CO2有利于维持催化剂Cu2O的量不变,原因是:_______________________(用化学方程式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com