
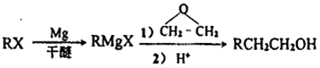
 (苯环上的-NH2易被氧化).
(苯环上的-NH2易被氧化). .
.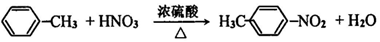 .
. .
. .
.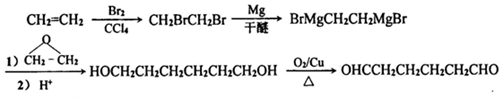 .
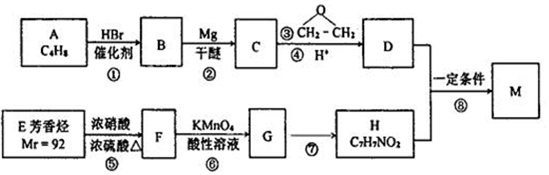
. 分析 B的核磁共振氢谱只有1个吸收峰,应为C(CH3)3Br,则A为CH3C(CH3)=CH2,由题给信息可知反应②生成C为C(CH3)3CH2CH2OH,H苯环上有两种化学环境的氢,且M为对氨基苯甲酸酯类,则H应为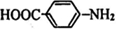 ,M为
,M为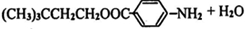 ,由转化关系可知E为
,由转化关系可知E为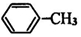 ,F为
,F为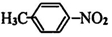 ,G为
,G为 ,以此解答该题.
,以此解答该题.
解答 解:(1)由以上分析可知A为CH3C(CH3)=CH2,为2-甲基丙烯,B为C(CH3)3Br,含有的官能团为溴原子,反应⑦为硝基生成氨基的反应,为还原反应,
故答案为:2-甲基丙烯;溴原子;还原反应;
(2)H为 ,含有氨基和羧基,可发生缩聚反应,产物为
,含有氨基和羧基,可发生缩聚反应,产物为 ,
,
故答案为: ;
;
(3)反应⑤为甲苯的硝化反应,方程式为 ,
,
反应⑧为酯化反应,方程式为 ,
,
故答案为: ;
; ;
;
(4)G中苯环上有-NH2,因氨基也可被酸性高锰酸钾氧化,则不能调换,
故答案为:调换后G中苯环上有-NH2,易被酸性KMNO4溶液氧化,得不到H;
(5)A为CH3C(CH3)=CH2,对应的同分异构体可能为烯烃或环烷烃,对应的烯烃有1-丁烯、2-丁烯、2-甲基丙烯;对应的环烷烃有环丁烷、甲基环丙烷,共5种,其中核磁共振氢谱只有一组吸收蜂的结构简式为 ,
,
故答案为:5; ;
;
(6)以乙烯和环氧乙烷为原料(无机试剂任选)制备1,6-己二醛,可先用乙烯与溴发生加成反应生成1,2-二溴乙烷,然后生成BrMgCH2CH2MgBr,与环氧乙烷反应生成HOCH2CH2CH2CH2CH2CH2OH,氧化可生成OHCCH2CH2CH2CH2CHO,
流程为 ,
,
故答案为: .
.
点评 本题考查有机物推断,为高考常见题型和高频考点,侧重考查学生的分析能力,注意把握有机物的结构与性质、有机反应类型、有机反应方程式和限制条件同分异构体的书写等知识,注意根据反应条件及有机物结构进行推断,需要学生熟练掌握官能团的性质与转化,难度中等.


 一线名师提优试卷系列答案
一线名师提优试卷系列答案 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:解答题
 铜和稀硝酸反应时,会出现奇妙的速率变化,开始时二者的反应速率非常慢,但随着反应的进行,反应速率却逐渐明显加快.对于上述变化的原因,课外活动小组同学进行了实验探究.
铜和稀硝酸反应时,会出现奇妙的速率变化,开始时二者的反应速率非常慢,但随着反应的进行,反应速率却逐渐明显加快.对于上述变化的原因,课外活动小组同学进行了实验探究.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,pH=2的硫酸溶液中,由水电离出的H+个数为10-12NA | |
| B. | 标准状况下,1.12L二氯甲烷含氯离子数为0.2NA | |
| C. | 向过量FeI2溶液中通入Cl2,当有1mol Fe2+被氧化时,转移的电子数为3NA | |
| D. | 2molNH3与3molO2在催化剂作用下加热充分反应后,所得NO分子数小于2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱性:Ca(OH)2>Mg(OH)2 | B. | 酸性:H2SO3>H2CO3 | ||
| C. | 热稳定性:NH3<PH3 | D. | 还原性:S2-<Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1molHCl气体 | B. | 0.1molNa2SO4固体 | ||
| C. | 0.2molNaOH固体 | D. | 0.1mol葡萄糖晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | X | Y | Z | W |
| 性质 结构 信息 | 工业上常用电解熔融XW2制取X的单质. | Y的最外层电子数比最内层电子数多1. | Z的最高价氧化物的水化物经聚合、脱水,可作袋装食品干燥剂. | W的一种气态氧化物甲对空气的相对密度为3,它溶于水得到单一溶质的弱酸性溶液(有漂白性),该溶液光照后酸性增强. |
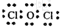 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验要求 | 化学试剂 |
| (1)检验酒精中是否有水 | ④ |
| (2)吸收CO中的H2O | ② |
| (3)验证味精中是否有食盐 | ① |
| (4)分离碘水中的碘 | ③ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 乙烷(乙烯):将混合气体通过酸性高锰酸钾溶液,洗气 | |
| B. | 苯(苯酚):向混合液中加入适量的浓溴水,过滤 | |
| C. | 乙酸乙酯(乙酸、乙醇):向混合液中加入饱和碳酸钠溶液,分液 | |
| D. | 硝基苯(NO2):向溶有杂质的硝基苯中加入一定量的浓氢氧化钠溶液,振荡,分液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| 氢氧化物 | 开始沉淀时的pH | 完全沉淀时的pH |
| Mg(OH)2 | 9.3 | 10.8 |
| Fe(OH)2 | 7.6 | 9.6 |
| Fe(OH)3 | 2.7 | 3.7 |
| Al(OH)3 | 3.7 | 4.7 |
| A. | 反应①中H2O2主要用于还原剂 | |
| B. | 滤渣1和滤渣2都不能溶于NaOH溶液 | |
| C. | 反应③发生主要反应的离子方程式:H++OH-═H2O | |
| D. | 以滤渣2为原料可以制备涂料铁红 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com