
| A.溴离子具有氧化性 | B.溴离子的还原性比氯离子弱 |
| C.该反应属于复分解反应 | D.氯气的氧化性比溴单质强 |
 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案科目:高中化学 来源:不详 题型:填空题
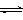 2CrO42- + 2H+
2CrO42- + 2H+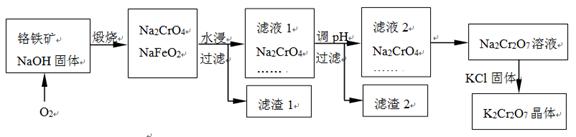 K2Cr2O7中Cr元素的化合价是 。
K2Cr2O7中Cr元素的化合价是 。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
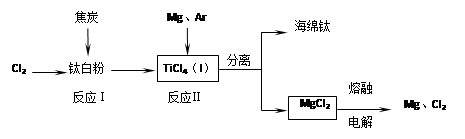
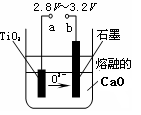
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
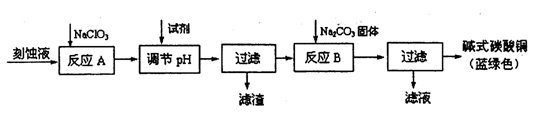
| 物质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 6.0 | 7.5 | 1,4 |
| 沉淀完全pH | 13 | 14 | 3.7 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.加入明矾,使海水的盐分沉淀并淡化 |
| B.利用太阳能,将海水蒸馏淡化 |
| C.将海水通过离子交换树脂,以除去所含的盐分 |
| D.利用半透膜,采用反渗透法而使海水淡化 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| | 金属 | 存在形式 | 冶炼方法 |
| A | 金 | 游离态 | 金子比沙子密度大,利用水洗法直接分离 |
| B | 银 | 化合态 | 银的金属性弱,用加热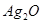 的方法冶炼 的方法冶炼 |
| C | 铁 | 化合态 | 铝的金属性比铁强,可用铝热法炼铁 |
| D | 钠 | 化合态 | 钠的金属性强,一般还原剂很难将其还原出来,所以用电解饱和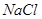 溶液方法冶炼 溶液方法冶炼 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| A.此法的优点之一是原料来源丰富 |
| B.进行①②③步骤的目的是从海水中提取氯化镁 |
| C.第④步电解制镁是由于镁是很活泼的金属 |
| D.以上制取镁的过程中涉及的反应有分解反应、化合反应和置换反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.制钛:用金属钠置换氯化钛(TiCl4)溶液中的钛 |
| B.炼铁:用焦炭和空气反应产生的CO在高温下还原铁矿石中的铁 |
| C.制钠:用海水为原料制得精盐,再电解纯净的NaCl溶液 |
| D.炼铜:用黄铜矿(主要成分为CuFeS2)直接电解精炼得到纯度为99.9%的铜 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com